Содержание
- 2. Составление уравнений окислительно-восстановительных реакций
- 3. Алгоритм расстановки коэффициентов методом электронного баланса: 1. Определить степени окисления элементов в реагентах и продуктах реакции.
- 4. 2. Подчеркнуть элементы, степени окисления которых изменяются. Al0 + H+1Cl-1 → Al+3Cl3-1 + H20
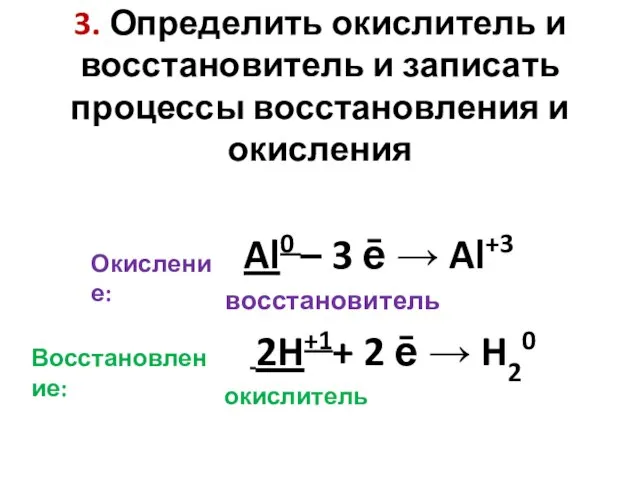
- 5. 3. Определить окислитель и восстановитель и записать процессы восстановления и окисления Окисление: Al0 – 3 ē
- 6. 4. Указываем число отданных и принятых электронов и находим наименьшее общее кратное. Al0 – 3 ē
- 7. 5. Расставляем коэффициенты перед формулами окислителя и восстановителя. Al + HCl → AlCl3 + H2 2
- 9. Скачать презентацию





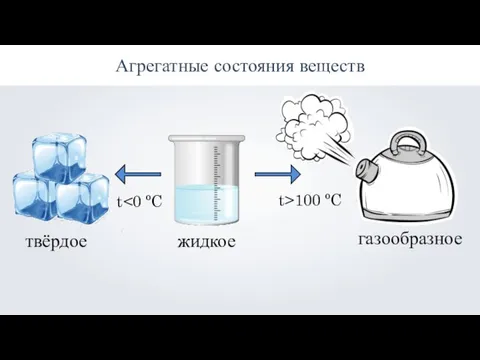 Агрегатные состояния веществ: твёрдое, жидкое, газообразное
Агрегатные состояния веществ: твёрдое, жидкое, газообразное Химические свойства оснований
Химические свойства оснований Классы неорганических соединений (основания)
Классы неорганических соединений (основания) Алкины
Алкины Презентация на тему Экологические риски при добыче и переработке нефти
Презентация на тему Экологические риски при добыче и переработке нефти  10 класс природные источники углеводородов
10 класс природные источники углеводородов Юный химик. Интерактивная интеллектуальная игра
Юный химик. Интерактивная интеллектуальная игра Теория строения химических соединений
Теория строения химических соединений Алюминий. Из истории открытия
Алюминий. Из истории открытия Галогены
Галогены Закономерности процессов тепло- и газообмена на пожаре
Закономерности процессов тепло- и газообмена на пожаре Cкорость химических реакций
Cкорость химических реакций Основания и их свойства
Основания и их свойства Алмазы
Алмазы Скорость химических реакций
Скорость химических реакций Исследование концентрированных заквасок для сметаны
Исследование концентрированных заквасок для сметаны Комплексные соединения
Комплексные соединения Lektsia_4_Tochechnye_gruppy_simmetrii_Simvoly_Shenflisa
Lektsia_4_Tochechnye_gruppy_simmetrii_Simvoly_Shenflisa Электролитическая диссоциация
Электролитическая диссоциация Типичные реакции оснований
Типичные реакции оснований Соли
Соли Образование и получение веществ
Образование и получение веществ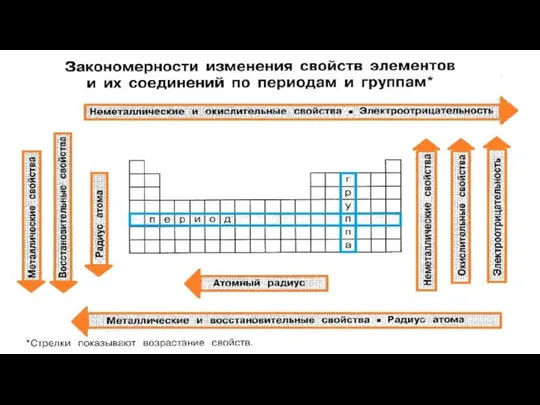 Закономерности изменения свойств элементов и их соединений по периодам и группам
Закономерности изменения свойств элементов и их соединений по периодам и группам Спирты и их производные. Применение метанола и этанола
Спирты и их производные. Применение метанола и этанола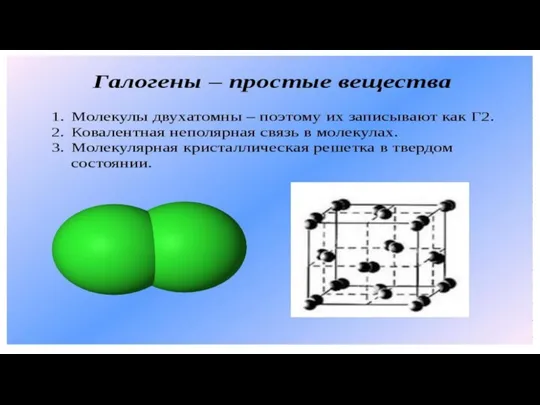 Галогены - простые вещества
Галогены - простые вещества Презентация на тему Теория строения химических соединений А.М.Бутлерова
Презентация на тему Теория строения химических соединений А.М.Бутлерова  Классификация ХГ методов разделения
Классификация ХГ методов разделения Угольная кислота и ее соли
Угольная кислота и ее соли