Содержание
- 2. Окислительно – восстановительные реакции … – реакции, протекающие с изменением степени окисления элементов.
- 3. Два антипода парою ходят, Первый – теряет; второй - находит, Ролью меняясь при этом порой… Кто
- 4. Основные положения теории ОВР.
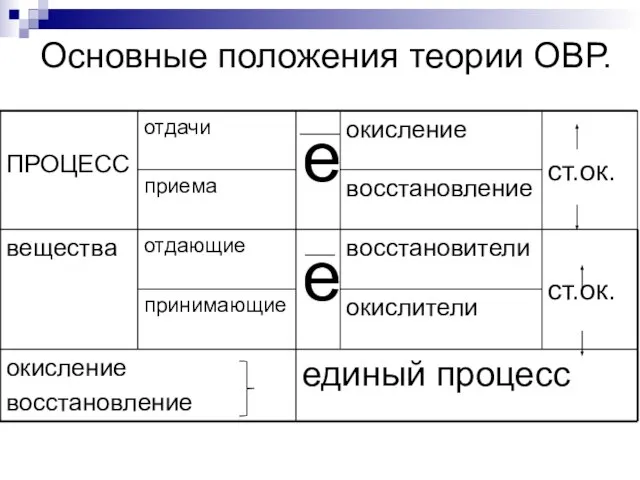
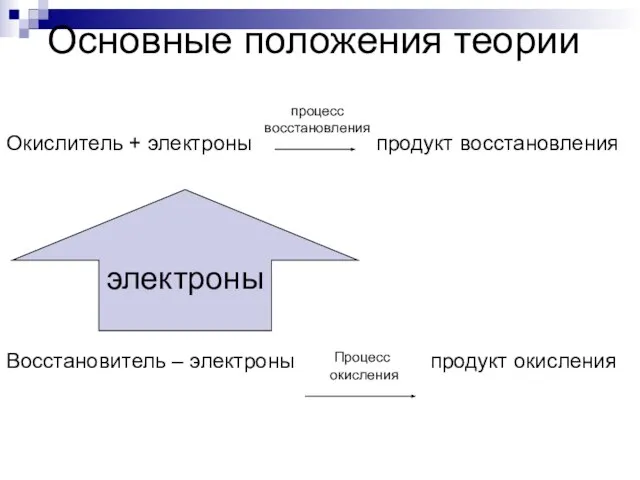
- 5. Окислитель + электроны продукт восстановления Восстановитель – электроны продукт окисления процесс восстановления электроны Процесс окисления Основные
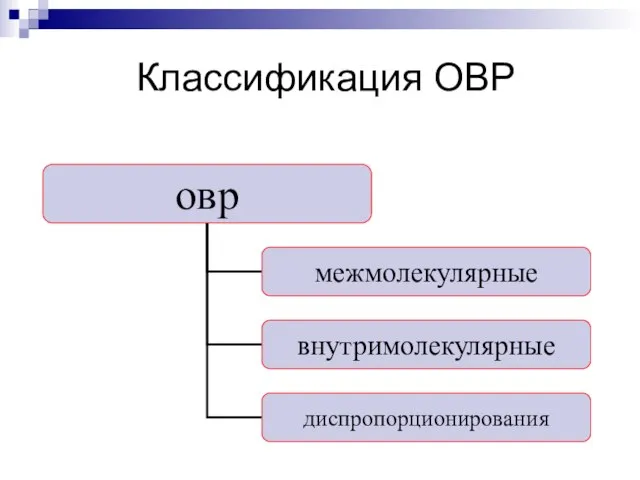
- 6. Классификация ОВР
- 7. Алгоритм составления ОВР Определить степени окисления элементов в соединениях, участвующих в реакции. Выявить элемент, степень окисления
- 8. Число отданных и принятых электронов должно быть одинаковым. Если это не так, то составить электронный баланс:
- 9. Алгоритм определения степеней окисления
- 10. Восстановитель Калий Галлий
- 11. Э Э n+ Атомы металлов (I и II гр., Al, Fe, Zn…). Отрицательно заряженные ионы неметаллов
- 12. Азот Фтор Окислитель
- 13. Окислитель Э Э n- Атомы элементов VI–VII групп (О2, Сl2…). Ионы металлов в высоких степенях окисления
- 14. Степень окисления – Условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все
- 16. Сера (-2,0,+2,+4,+6) Железо ( +2, +3)
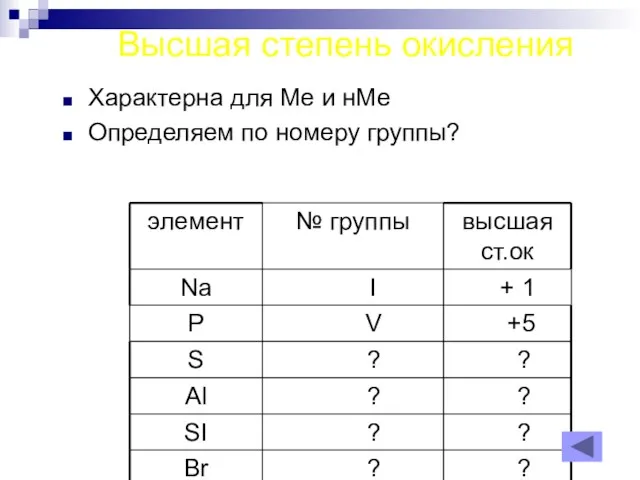
- 17. Высшая степень окисления Характерна для Ме и нМе Определяем по номеру группы?
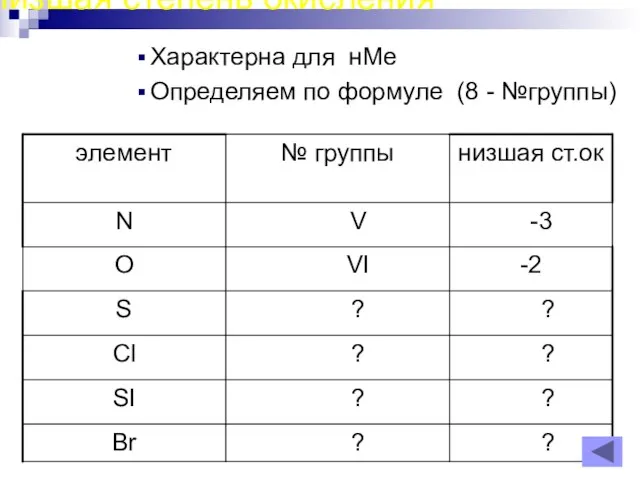
- 18. Низшая степень окисления Характерна для нМе Определяем по формуле (8 - №группы)
- 19. Нулевая ( 0) Все простые вещества Бром Литий Йод
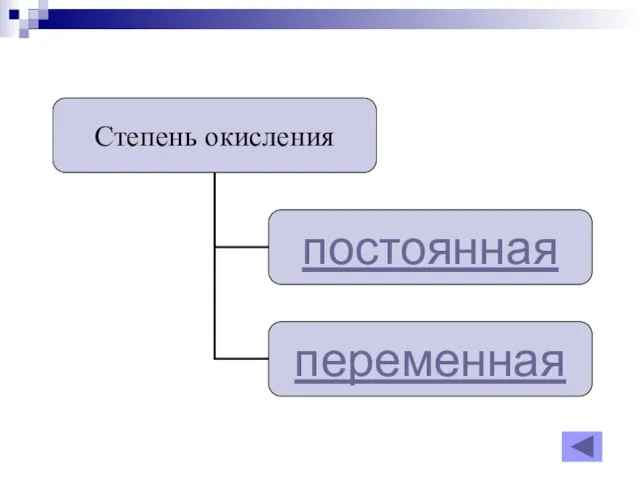
- 20. постоянная
- 21. Тест для 8 класса Тема: «Окислительно – восстановительные реакции»
- 22. Инструкция по выполнению теста Внимательно прочитайте задание и выберите правильный ответ – нажмите справа на нужную
- 23. Степень окисления серы K2SO3 в равна +3 +2 +6 +4
- 24. Окислительно - восстановительная реакция CaO+Co2=CaCO3 NaOH+HCl=NaHCl+H2O Fe+CuSO4=FeSO4+Cu Na3SiO3+2HCl=2NaCl+H2SiO3
- 25. Окислитель Принимает электроны Окисляется Отдаёт электроны Не изменяет степень окисления
- 26. Магний имеет минимальное значение степени окисления +2 -2 0 +1
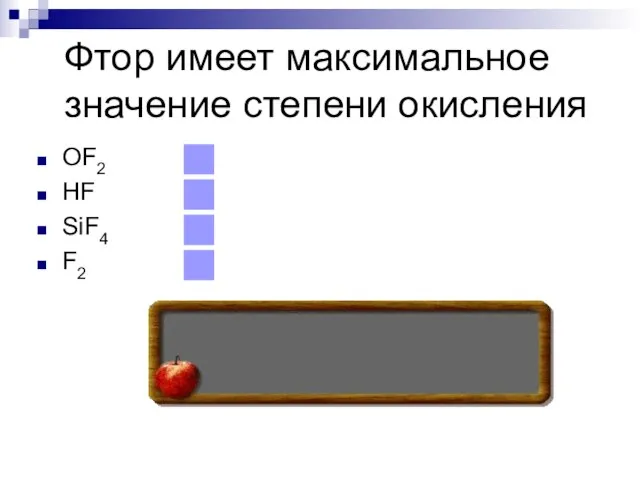
- 27. Фтор имеет максимальное значение степени окисления OF2 HF SiF4 F2
- 28. Конец тестирования Молодец! Справились верно с 5 заданиями Отличная работа!
- 29. Вы ответили неправильно! Прочитайте параграф 43 ещё раз. Выполните тестовое задание снова. Закончить тестирование! Вернуться на
- 31. Скачать презентацию





















 Изучение зависимости скорости химической реакции от различных факторов. Практическая работа № 6
Изучение зависимости скорости химической реакции от различных факторов. Практическая работа № 6 Исследовательская работа по химии на тему: Интегративные проблемные ситуации
Исследовательская работа по химии на тему: Интегративные проблемные ситуации Тест по теме Альдегиды и кетоны
Тест по теме Альдегиды и кетоны Материаловедение. Модуль
Материаловедение. Модуль Синтез оксида меди и йодида меди для формирования буферных слоев для ГОНП
Синтез оксида меди и йодида меди для формирования буферных слоев для ГОНП Обобщение и систематизация знаний по теме Вещества и их классификация
Обобщение и систематизация знаний по теме Вещества и их классификация Металлы
Металлы lektsia_6 (1)
lektsia_6 (1) Изучение возможности синтеза порошка сложного карбонитрида -титана молибдена Ti-Mo в режиме СВС
Изучение возможности синтеза порошка сложного карбонитрида -титана молибдена Ti-Mo в режиме СВС Development of the system of concepts on the topic redox reactions in the school course of inorganic chemistry
Development of the system of concepts on the topic redox reactions in the school course of inorganic chemistry Кристаллы
Кристаллы Электродные процессы. Электроды. Потенциометрия
Электродные процессы. Электроды. Потенциометрия Клеящие материалы
Клеящие материалы Алкены
Алкены Презентация на тему Арены (10 класс)
Презентация на тему Арены (10 класс)  Химия элементов VIA группы
Химия элементов VIA группы Радон (222Rn)
Радон (222Rn) Основные классы неорганических соединений. Мы едем, едем, едем…
Основные классы неорганических соединений. Мы едем, едем, едем… Практические занятия по теме: Методы защиты энергооборудования от коррозии (1)
Практические занятия по теме: Методы защиты энергооборудования от коррозии (1) Оксид серы (VI) SO3
Оксид серы (VI) SO3 Химическая картина мира
Химическая картина мира valentnost
valentnost Reactivi444
Reactivi444 Тест по теме Основные классы неорганических соединений
Тест по теме Основные классы неорганических соединений Классы неорганических соединений Подготовка к ЕГЭ
Классы неорганических соединений Подготовка к ЕГЭ Получение и примененипе радиоактивные изотопы
Получение и примененипе радиоактивные изотопы Презентация на тему Химическая промышленность мира
Презентация на тему Химическая промышленность мира