Содержание
- 2. Биологические функции белков
- 3. Структурная (строительная, пластическая) функция Эта функция заключается в том, белки являются универсальным строительным материалом, из которого
- 4. Каталитическая функция В организме имеются особые белки, являющиеся катализаторами химических реакций. Такие белки получили название ферменты
- 5. Сократительная функция В основе всех форм движения и в первую очередь мышечного сокращения и расслабления лежит
- 6. Регуляторная функция Белки обладают амфотерностью и могут взаимодействовать как с кислотами, так и с основаниями. Поэтому
- 7. Транспортная функция Белковые молекулы имеют большой размер, хорошо растворимы в воде и, перемещаясь по водным пространствам
- 8. Защитная функция Белки выполняют защитную функцию, участвуя в обеспечении иммунитета. К защитной функции относится участие белков
- 9. Энергетическая функция Окисление белков, как и всех других органических соединений, сопровождается выделением энергии. При окислении 1
- 10. Исходя из важнейшей биологической роли белков в организме, их еще называют протеинами (от греч. рroteus –
- 11. Строение белков Белки - высокомолекулярные азотсодержащие соединения, состоящие из аминокислот. В одну молекулу белков входят десятки,
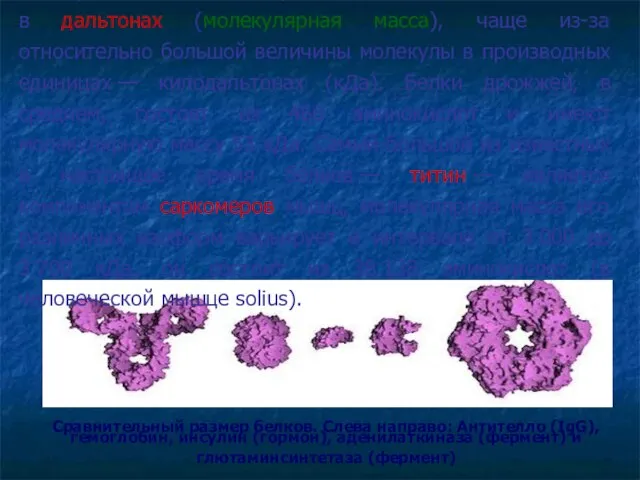
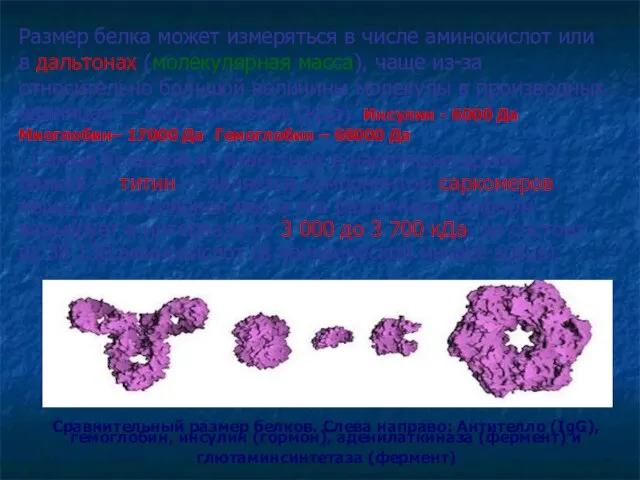
- 12. Сравнительный размер белков. Слева направо: Антителло (IgG), гемоглобин, инсулин (гормон), аденилаткиназа (фермент) и глютаминсинтетаза (фермент) Размер
- 13. Общая формула аминокислот R H-C-NH2 COOH
- 14. Классификация аминокислот Аминокислоты ациклические циклические (15) (5)
- 15. Классификация ациклических аминокислот Ациклические аминокислоты моноаминомонокарбоновые моноаминодикарбоновые диаминомонокарбоновые
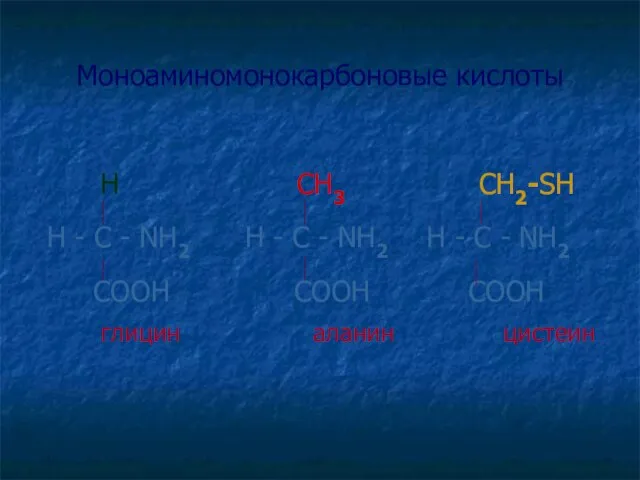
- 16. Моноаминомонокарбоновые кислоты H СН3 СН2-SH H - C - NH2 H - C - NH2 H
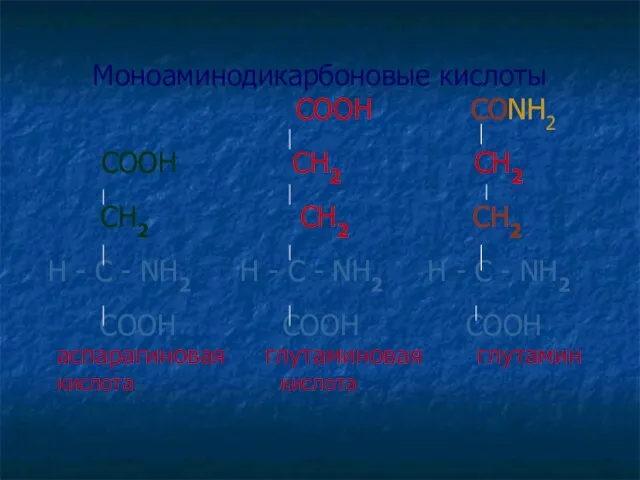
- 17. Моноаминодикарбоновые кислоты СООН СОNH2 СООН СН2 СН2 СH2 СН2 СН2 H - C - NH2 H
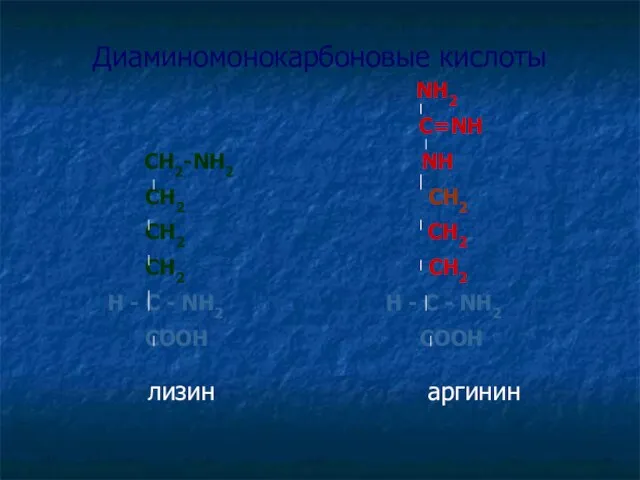
- 18. Диаминомонокарбоновые кислоты NH2 C=NH СН2-NH2 NH СH2 СH2 СН2 СН2 СH2 СН2 H - C -
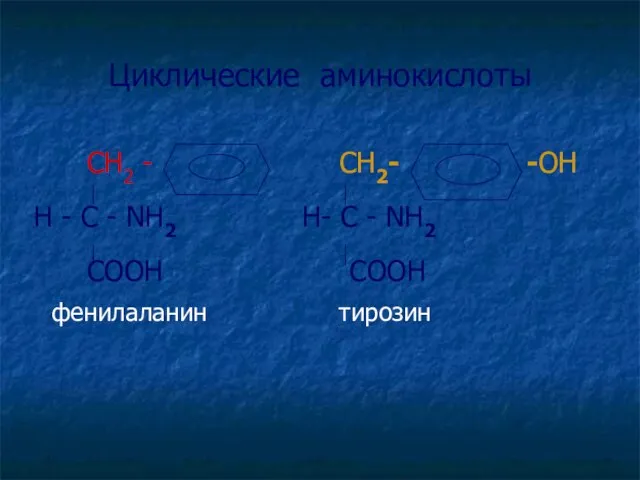
- 19. Циклические аминокислоты СН2 - СН2- -ОН H - C - NH2 Н- C - NH2 COOH
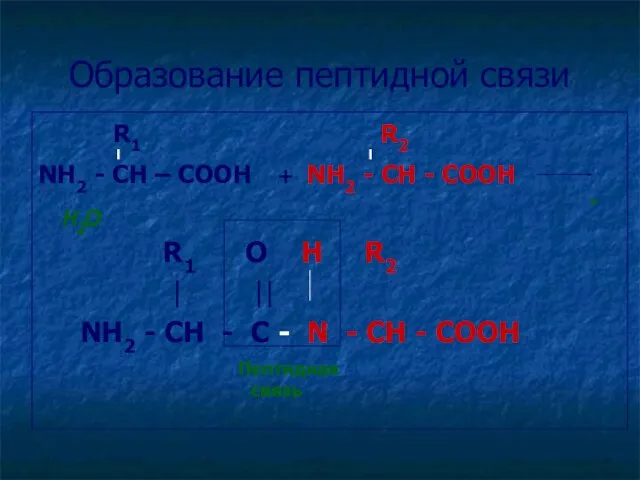
- 20. Образование пептидной связи R1 R2 NH2 - CH – COOH + NH2 - CH - COOH
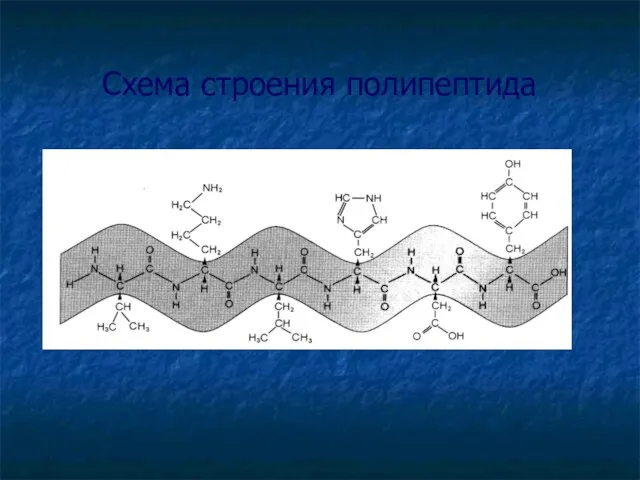
- 21. Схема строения полипептида
- 22. Полипептидная цепь белка трипсина
- 23. Участок молекулы коллагена
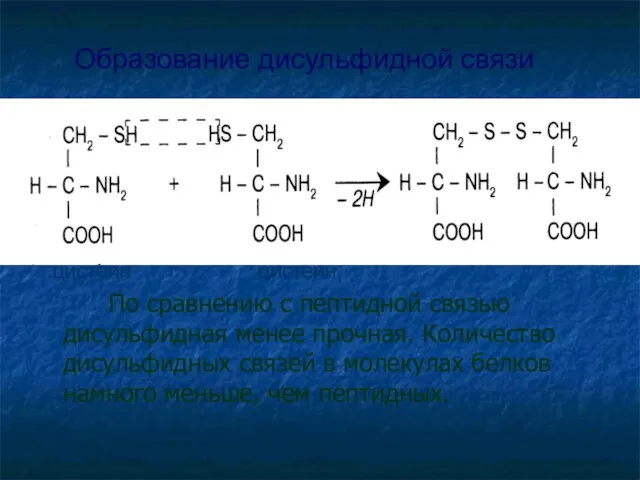
- 24. цистеин цистеин По сравнению с пептидной связью дисульфидная менее прочная. Количество дисульфидных связей в молекулах белков
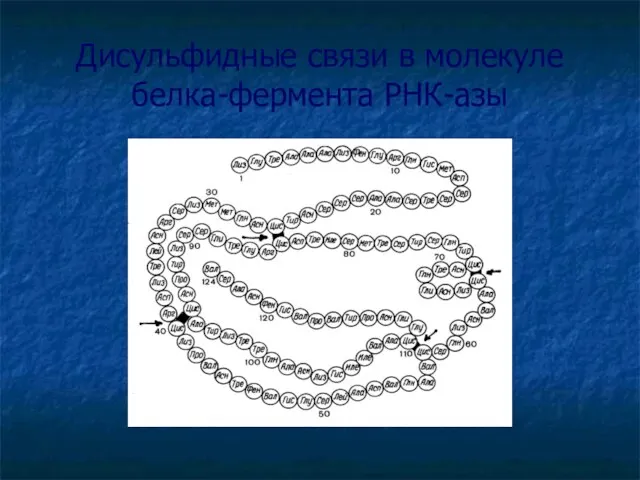
- 25. Дисульфидные связи в молекуле белка-фермента РНК-азы
- 26. Дисульфидные связи в молекуле инсулина
- 27. Классификация белков (по химическому составу) Простые белки Сложные белки (протеины) (протеиды) 1. Альбумины 1. Фосфопротеиды 2.
- 28. Тест 1 Содержание белков в организме взрослого человека составляет: а) 8-10 % б) 15-17 % в)
- 29. Тест 2 Обязательным химическим элементом, входящим в состав белков, является: а) азот б) кальций в) селен
- 30. Тест 3 Во все белки входят: а) 10 разновидностей аминокислот б) 20 разновидностей аминокислот в) 30
- 31. Тест 4 В состав аминокислот обязательно входят функциональные группы: а) альдегидная и спиртовая б) карбоксильная и
- 32. Тест 5 Главной химической связью в белках является: а) водородная б) дисульфидная в) ионная г) пептидная
- 33. Тест 6 Простые белки отличаются от сложных: а) молекулярной массой б) отсутствием дисульфидных связей в) отсутствием
- 34. Тест 7 Сложные белки отличаются от простых: а) изоэлектрической точкой б) наличием дисульфидных связей в) наличием
- 35. Тест 8 В образовании дисульфидной связи участвует аминокислота: а) аланин б) глицин в) глутамин г) цистеин
- 36. Тест 9 Формулу СН2-NH2 COOH имеет аминокислота: а) аланин б) глицин в) глутамин г) цистеин
- 37. Тест 10 Формулу СООН СН2 СН2-NH2 COOH имеет аминокислота: а) аспарагиновая кислота б) глутамин в) глутаминовая
- 38. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ
- 39. Сравнительный размер белков. Слева направо: Антителло (IgG), гемоглобин, инсулин (гормон), аденилаткиназа (фермент) и глютаминсинтетаза (фермент) Размер
- 40. Пространственная форма белковых молекул В молекуле белка условно выделяют четыре уровня её пространственной организации: Первичная структура
- 41. Первичная структура Первичная структура представляет собой последовательность расположения аминокислот в полипептидных цепях. Фиксируется первичная структура прочными
- 42. Первичная структура белка трипсина
- 43. Вторичная структура Вторичная структура характеризует пространственную форму полипептидных цепей. Часто полипептидные цепи в белковых молекулах закручиваются
- 44. Полипептидная цепь в форме α-спирали
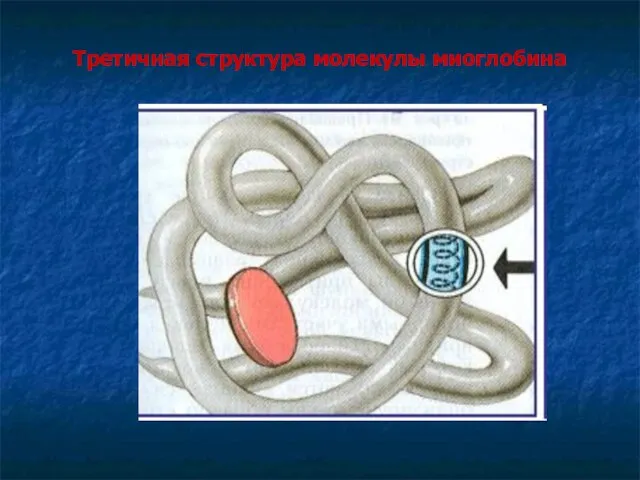
- 45. Третичная структура Третичная структура отражает пространственную форму вторичной структуры. Например, вторичная структура в форме спирали может
- 46. Третичная структура молекулы миоглобина
- 47. Конформация белка Пространственная форма всей белковой молекулы, являющаяся совокупностью первичной, вторичной и третичной структур обозначается термином
- 48. Четвертичная структура Четвертичной структурой обладают только некоторые белки. Четвертичная структура – сложное надмолекулярное образование, состоящее из
- 49. Объединение субъединиц в четвертичную структуру приводит к возникновению нового биологического свойства, отсутствующего у отдельных субъединиц. Образование
- 50. Схема строения белковой молекулы, обладающей четвертичной структурой
- 51. Из всех структур белковой молекулы кодируется только первичная. За счет информации, заключенной в молекуле ДНК, синтезируются
- 52. Кристаллы различных белков, выращенные на космической станции «Мир»Кристаллы различных белков, выращенные на космической станции «Мир» и
- 53. Классификация белков (по форме молекул) Глобулярные Фибриллярные 1. Альбумины 1. Коллаген 2. Глобулины 2. Кератины 3.
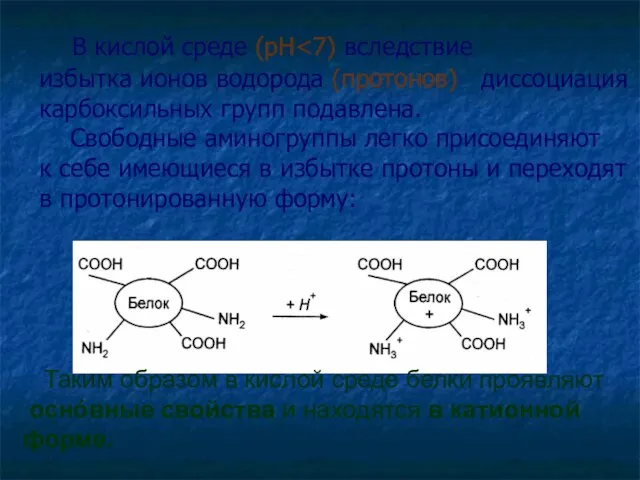
- 54. Амфотерность белков Амфотерность белков (наличие как кислотных, так и оснóвных свойств) обусловлена присутствием в их молекулах
- 55. В кислой среде (рН Таким образом в кислой среде белки проявляют оснóвные свойства и находятся в
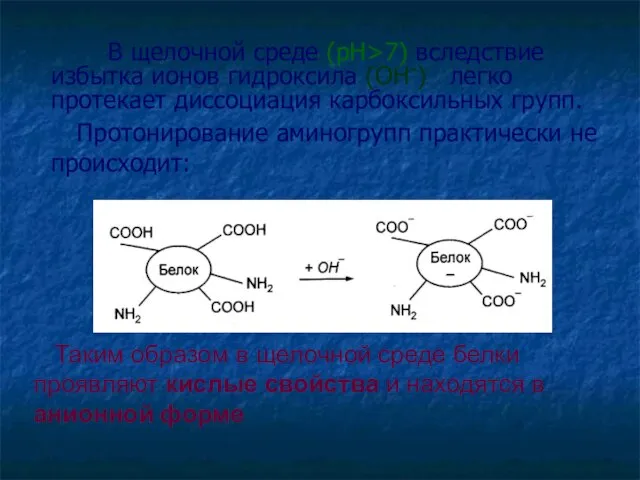
- 56. В щелочной среде (рН>7) вследствие избытка ионов гидроксила (ОН-) легко протекает диссоциация карбоксильных групп. Протонирование аминогрупп
- 57. Изоэлектрическое состояние При определенной кислотности в молекуле белка может быть одинаковое количество диссоциированных карбоксильных групп (–СОО-)
- 58. Значение рН, при котором молекулы белка нейтральны, называется изоэлектрической точкой и обозначается рI или рНиэт Для
- 59. Растворимость белков Не смотря на большой размер молекул (1–100 нм), белки хорошо растворяются в воде, и
- 60. Наличие заряда Только при одном строго определенном значении рН, равном изоэлектрической точке, белок нейтрален. При всех
- 61. Наличие гидратной оболочки У нативного белка гидрофобные группы (не взаимодействующие с водой) обычно находятся внутри молекулы,
- 62. Гидратная оболочка белковой молекулы
- 63. Высаливание белков Высаливание белков - выпадение белка в осадок под воздействием водоотнимающих средств, к которым в
- 64. В результате бóльшая часть воды связывается с ионами солей, что приводит к значительному уменьшению гидратных оболочек
- 65. Процесс высаливания не затрагивает структуру белковых молекул, поэтому в осадок выпадает белок, сохраняющий свою нативность, т.е.
- 66. Денатурация белков Денатурация – потеря белком нативных свойств. Денатурация обычно сопровождается выпадением белка в осадок. Факторы,
- 67. Физические факторы денатурации Нагревание (выше 50-60°С); различные виды излучения (ультрафиолетовое и ионизирующее излучение); ультразвук; вибрация.
- 68. Химические факторы денатурации Сильные кислоты; Сильные щелочи; Соли тяжелых металлов; Некоторые органические кислоты (трихлоруксусная, сульфосалициловая)
- 69. Механизм денатурации Под влиянием факторов денатурации в молекулах белков разрываются различные непептидные связи, что вызывает разрушению
- 70. Схема денатурации белка
- 71. Обратимость денатурации белка При кратковременном действии денатурирующих факторов конформационные изменения незначительны, поэтому возможен переход белка снова
- 72. Ренатурация белка а - денатурация б - ренатурация
- 73. Продолжительное воздействие факторов денатурации вызывает глубокое необратимое изменение трехмерной структуры белковых молекул, что делает ренатурацию невозможной.
- 74. Тест 1 Первичная структура белковой молекулы фиксируется: а) водородными связями б) дисульфидными связями в) ионными связями
- 75. Тест 2 Простые белки отличаются от сложных: а) молекулярной массой б) отсутствием дисульфидных связей в) отсутствием
- 76. Тест 3 При высаливании белок: а) подвергается гидролизу б) приобретает заряд в) теряет гидратную оболочку г)
- 77. Тест 4 При денатурации у белков в первую очередь изменяется структура: а) первичная б) вторичная в)
- 78. Тест 5 В кислой среде молекулы белков: а) имеют отрицательный заряд б) имеют положительный заряд в)
- 79. Тест 6 В щелочной среде молекулы белков: а) имеют отрицательный заряд б) имеют положительный заряд в)
- 80. Тест 7 При значении рН, равном изоэлектрической точке, молекулы белков: а) имеют отрицательный заряд б) имеют
- 81. Тест 8 Молекулы белков всегда нейтральны: а) в кислой среде б) в нейтральной среде в) в
- 82. Тест 9 Cложные белки отличаются от простых: а) изоэлектрической точкой б) наличием дисульфидных связей в) наличием
- 83. Тест 10 В молекуле ДНК содержится информация о: а) первичной структуре белка б) вторичной структуре белка
- 85. Скачать презентацию





































































 Алкены. Непредельные углеводороды, олефины
Алкены. Непредельные углеводороды, олефины Химическая связь
Химическая связь Классификация веществ
Классификация веществ Общая химия. Основные понятия
Общая химия. Основные понятия Соли
Соли Многоатомные спирты
Многоатомные спирты Степень окисления. Составление химических формул бинарных соединений
Степень окисления. Составление химических формул бинарных соединений Различные типы неорганических полимеров
Различные типы неорганических полимеров Лекция 10. Неорганическая химия. Сероводород
Лекция 10. Неорганическая химия. Сероводород Электролитическая диссоциация
Электролитическая диссоциация Внеклассное мероприятие по химии Первоначальные химические понятия
Внеклассное мероприятие по химии Первоначальные химические понятия Соли в свете теории электролитической диссоциации
Соли в свете теории электролитической диссоциации Металлы и неметаллы
Металлы и неметаллы Катаболизм пуриновых нуклеотидов
Катаболизм пуриновых нуклеотидов О́лово — элемент 14-й группы периодической системы химических элементов
О́лово — элемент 14-й группы периодической системы химических элементов Нефть. Состав и свойства
Нефть. Состав и свойства Презентация на тему Строение и свойства циклоалканов
Презентация на тему Строение и свойства циклоалканов  Минеральные продукты
Минеральные продукты Задача №2 Спящий Амур. Команда гимназии №1 Берлинская лазурь
Задача №2 Спящий Амур. Команда гимназии №1 Берлинская лазурь Углеводороды. 9 класс
Углеводороды. 9 класс Первые попытки классификации химических элементов
Первые попытки классификации химических элементов Презентация на тему Производство серной кислоты
Презентация на тему Производство серной кислоты  Практико-ориентированные задачи по химии для студентов гуманитарных специальностей
Практико-ориентированные задачи по химии для студентов гуманитарных специальностей Закономерности изменения окислительно-востановительных свойств соединений в периодах и группах
Закономерности изменения окислительно-востановительных свойств соединений в периодах и группах Как определять минералы
Как определять минералы Химическая реакция
Химическая реакция Внеклассное мероприятие по химии. Своя игра
Внеклассное мероприятие по химии. Своя игра Химические свойства кислот. 11 класс
Химические свойства кислот. 11 класс