Содержание
- 2. СТРОЕНИЕ АТОМА. Основные сведения.
- 3. Проверяем д/з: №2: А) Mr(CaO) = 40 + 16 = 56 Б) Mr(N2O5) = 14 ∙
- 4. №3: А) FeCl3 Mr(FeCl3) = 56 + 35,5 ∙ 3 = 162,5 Б) Al2O3 Mr(Al2O3) =
- 5. Выполните проверку: 1 вариант: Mr(CuCl2) = 64 + 35,5∙2 = 135 Mr(KNO3) = 39 + 14
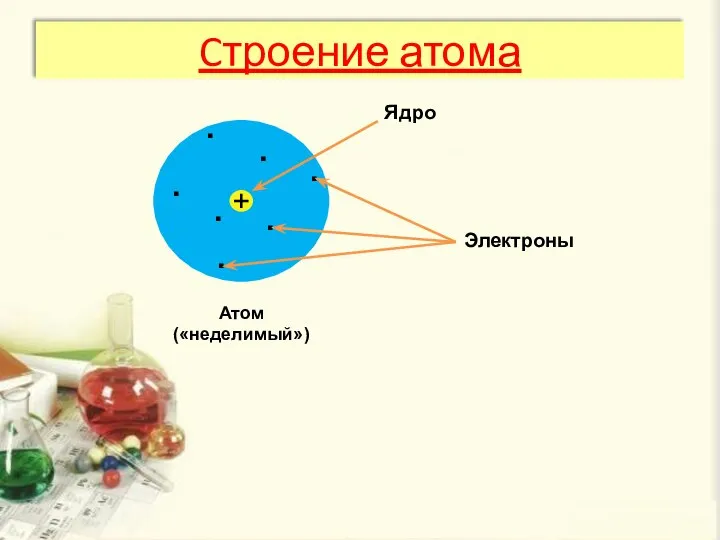
- 6. Cтроение атома Атом («неделимый») Ядро . . . . . . . Электроны
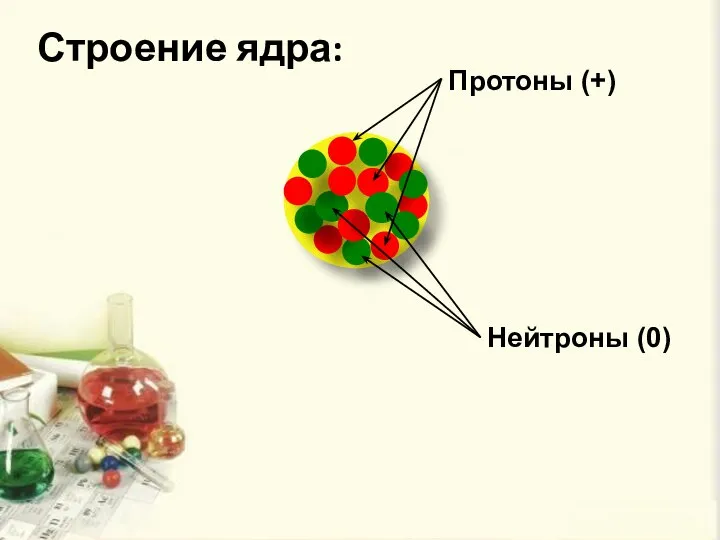
- 7. Строение ядра: Протоны (+) Нейтроны (0)
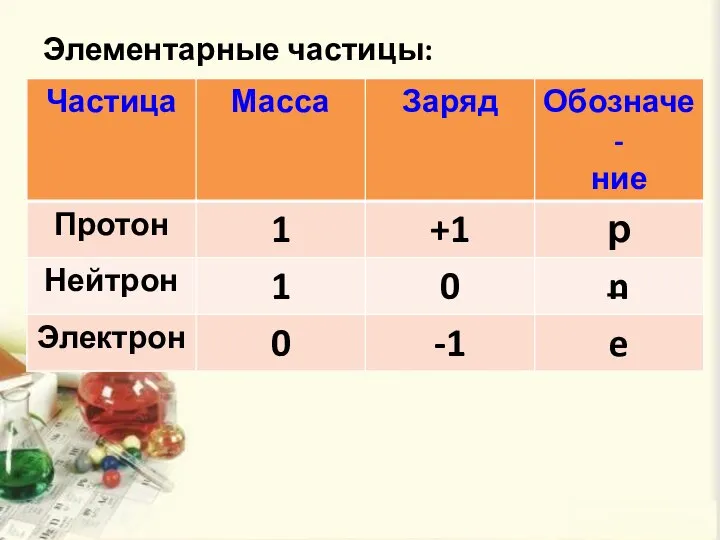
- 8. Элементарные частицы:
- 9. Правила: Атом не имеет заряда (электронейтрален). Сумма числа протонов и нейтронов в ядре называется массовым числом.
- 10. Строение атома лития: Li 3 7 Заряд ядра: +3 Строение ядра: 3p, 4n Строение атома: 3p,
- 11. Проверь себя! Как заряжено ядро в атоме? Какие частицы двигаются около ядра? Как заряжены электроны? Какие
- 12. Ответы: Положительно. Электроны. Отрицательно. Протоны и нейтроны. +1 0 По порядковому номеру элемента. +26 8 12
- 13. Домашнее задание: §7 №2, 4 Записать строение атомов любых 10-ти элементов. Составить формулы, найти Mr: А)
- 15. Скачать презентацию









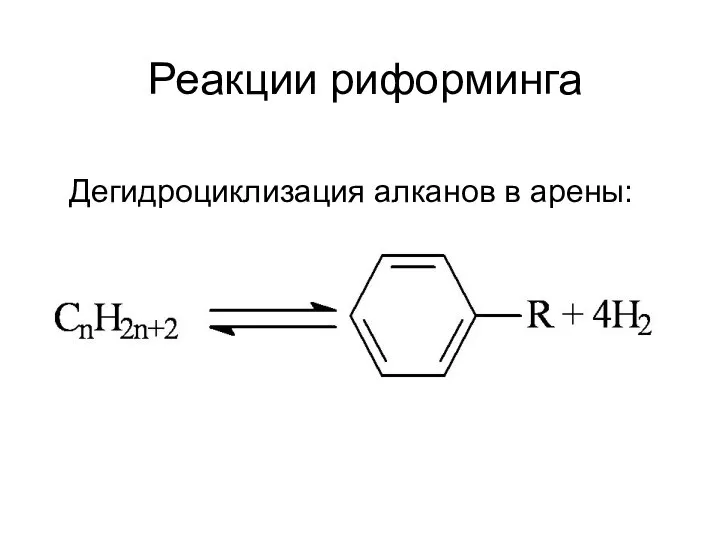 Реакции риформинга
Реакции риформинга Галогены
Галогены Производство серной кислоты контактным способом
Производство серной кислоты контактным способом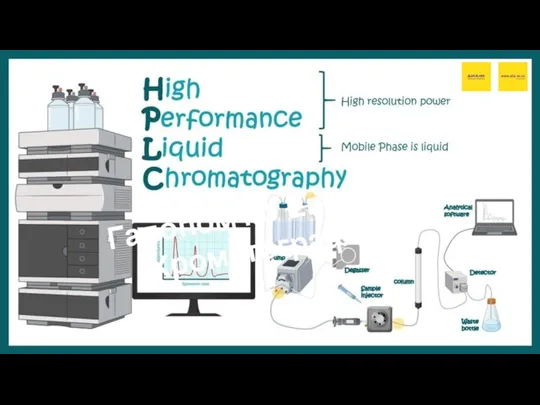 Хроматография
Хроматография Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс
Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс Знаки химических элементов. Периодическая система
Знаки химических элементов. Периодическая система Обобщение сведений об основных классах неорганических веществ. 8 класс
Обобщение сведений об основных классах неорганических веществ. 8 класс Аттестационная работа. Углеводы
Аттестационная работа. Углеводы Классификация углеводов: моносахариды, дисахариды, полисахариды. Химическая структура. Свойства и функция углеводов
Классификация углеводов: моносахариды, дисахариды, полисахариды. Химическая структура. Свойства и функция углеводов Металлы
Металлы Материаловедение. Технология конструкционных материалов. Диаграмма состояния Fe-Fe3C
Материаловедение. Технология конструкционных материалов. Диаграмма состояния Fe-Fe3C Классы неорганических соединений Подготовка к ЕГЭ
Классы неорганических соединений Подготовка к ЕГЭ Углеродистые конструкционные стали
Углеродистые конструкционные стали Химическая промышленность
Химическая промышленность Онлайн-школа подготовки к ЕГЭ по химии CharChem
Онлайн-школа подготовки к ЕГЭ по химии CharChem Анализ лекарственных форм с витаминами и использование физико-химических и химических методов анализа. Вопросы стабилизации
Анализ лекарственных форм с витаминами и использование физико-химических и химических методов анализа. Вопросы стабилизации Химический опыт Черный сахар
Химический опыт Черный сахар Презентация на тему Важнейшие соединения серы
Презентация на тему Важнейшие соединения серы  Кинетика химических реакций
Кинетика химических реакций Углеводороды: соединения, состоящие из углерода и водорода
Углеводороды: соединения, состоящие из углерода и водорода Минеральные компоненты молока и молочных продуктов. Макроэлементы
Минеральные компоненты молока и молочных продуктов. Макроэлементы Ароматические углеводороды. Арены
Ароматические углеводороды. Арены Современные представления о строении атома
Современные представления о строении атома Металлы и их соединения. Решение экспериментальных задач
Металлы и их соединения. Решение экспериментальных задач Химия в профессии ювелира
Химия в профессии ювелира Кристаллы
Кристаллы Ковалентная связь. Радикалы
Ковалентная связь. Радикалы Азотосодержащие соединения: Амины. Аминокислоты. Белки
Азотосодержащие соединения: Амины. Аминокислоты. Белки