Содержание
- 2. Не нужен университет, Ни Кембридж, и ни Оксфорд, Чтобы узнать: латинской «Р» Обозначают …
- 3. Паспортные данные фосфора Перечислите элементы V группы. Охарактеризуйте фосфор по положению в периодической системе химических элементов
- 4. Фосфор впервые получил в 1669 г. алхимик из Гамбурга Хеннинг Бранд. Подобно другим алхимикам, он пытался
- 5. К.В. Шееле (1742–1786) Вскоре Ю. Ган и К Шееле доказали, что в костях содержится много фосфора.
- 6. «Да! Это была собака, огромная, черная как смоль… Из ее отверстой пасти вырывалось пламя, глаза метали
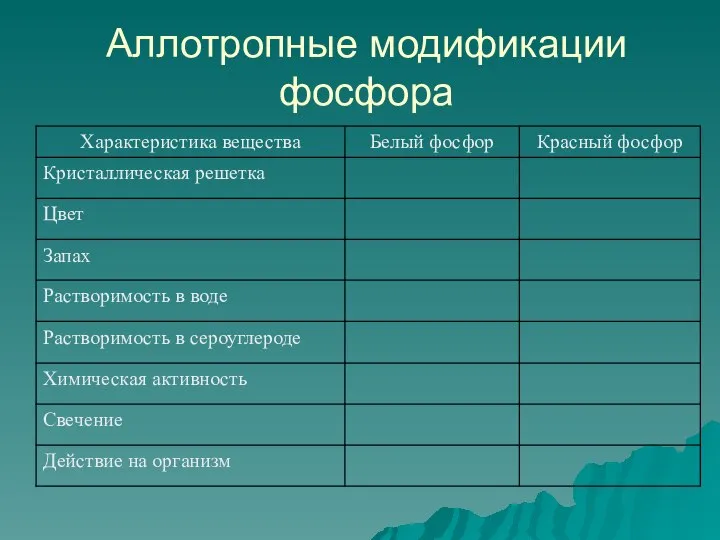
- 7. Аллотропные модификации фосфора
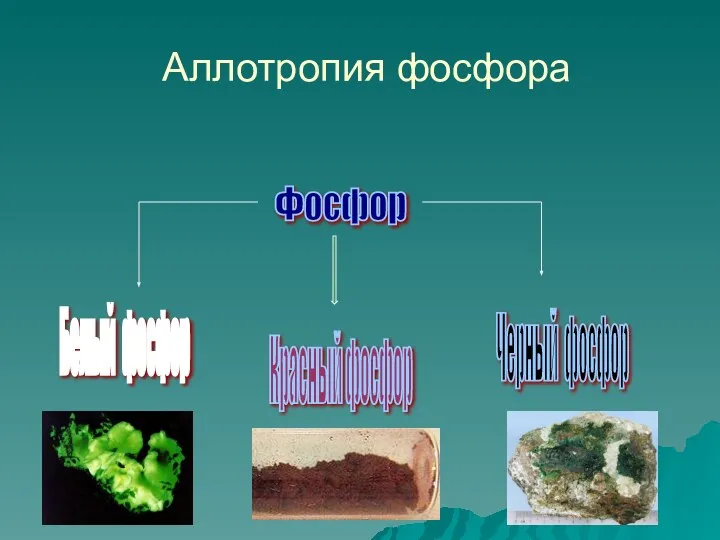
- 8. Аллотропия фосфора Фосфор Белый фосфор Красный фосфор Черный фосфор
- 9. Белый фосфор Наиболее распространен белый, или желтый, фосфор. Белый фосфор имеет молекулярную решетку, в узлах которой
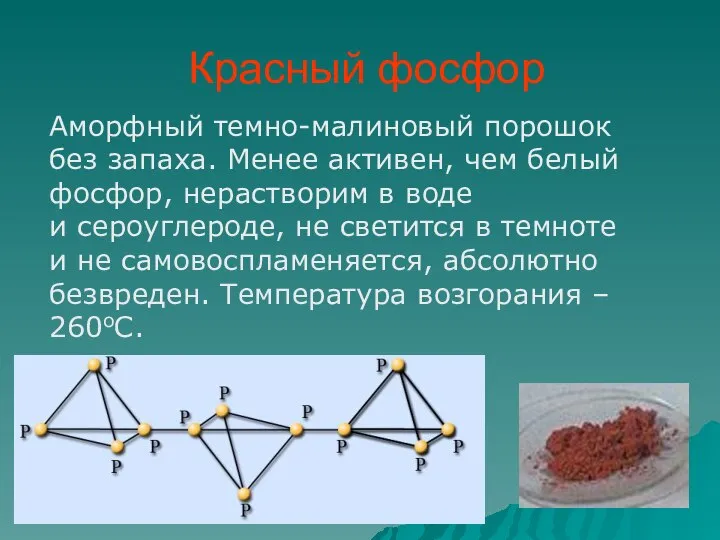
- 10. Красный фосфор Аморфный темно-малиновый порошок без запаха. Менее активен, чем белый фосфор, нерастворим в воде и
- 11. Черный фосфор Ромбическая модификация Кубическая модификация Имеет атомную кристаллическую решетку. По внешним признакам черный фосфор напоминает
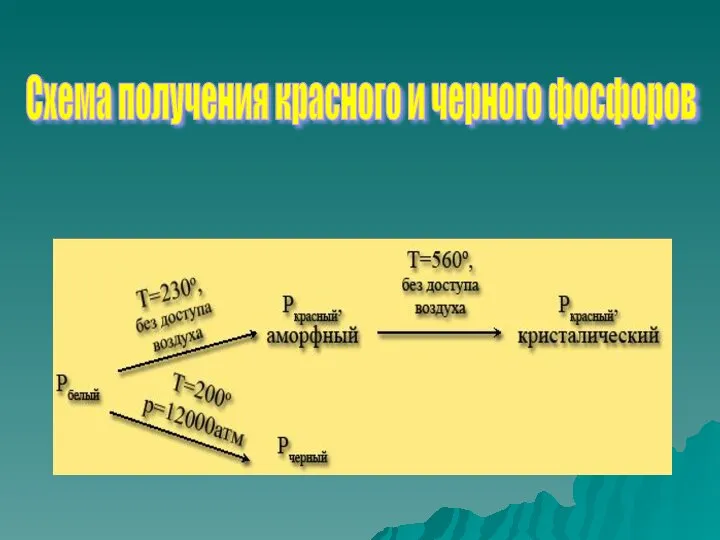
- 12. Схема получения красного и черного фосфоров
- 13. Фосфор в природе Фосфор встречается в природе только в связанном состоянии. Массовая доля фосфора в земной
- 14. Химические свойства Взаимодействие с активными металлами: Mg + P → Взаимодействие с кислородом: Р + О2
- 15. Биологическое значение По содержанию в организме человека фосфор относится к макроэлементам (w(Р) = 0,95%). Фосфор входит
- 16. Применение фосфора Более половины объема мирового производства фосфора перерабатывается в соединения, используемые в синтетических моющих средствах.
- 17. Станция поэтическая Я светоносный элемент. Я спичку вам зажгу в момент. Сожгут меня – и под
- 18. Станция контрольная 1. Сколько электронов в атоме фосфора находится на внешнем энергетическом уровне? 1) 2 ;
- 20. Скачать презентацию













 Взаимодействие кислот с металлами
Взаимодействие кислот с металлами Таблица Менделеева
Таблица Менделеева Образование химических соединений с учетом валентности элементов
Образование химических соединений с учетом валентности элементов Общая химическая технология. Составление материального баланса технологического процесса. Практическое занятие 6
Общая химическая технология. Составление материального баланса технологического процесса. Практическое занятие 6 Нефть - черное золото
Нефть - черное золото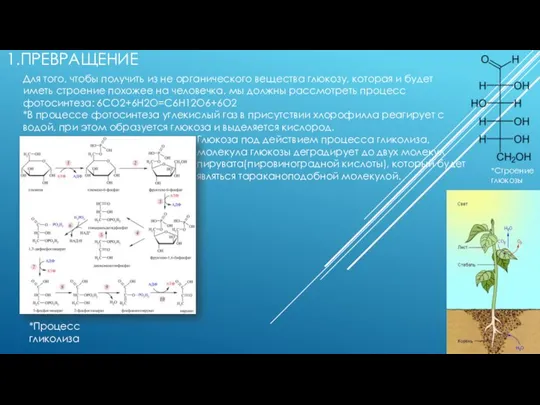 Превращение из не органического вещества в глюкозу
Превращение из не органического вещества в глюкозу Потенциодинамическая электрохимическая наногравиметрия теллура и его соединений
Потенциодинамическая электрохимическая наногравиметрия теллура и его соединений Физические свойства неметаллов
Физические свойства неметаллов Теория электролитической диссоциации
Теория электролитической диссоциации Презентация на тему Этиловый спирт и его влияние на организм человека
Презентация на тему Этиловый спирт и его влияние на организм человека  Teksta uzdevumi (1)
Teksta uzdevumi (1) Химическая связь
Химическая связь Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Сплавы металлов
Сплавы металлов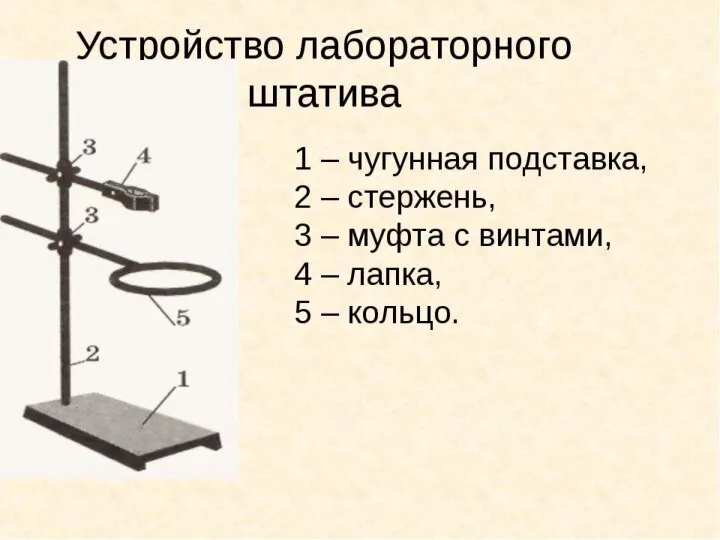 Устройство лабораторного штатива
Устройство лабораторного штатива Количество вещества
Количество вещества Химические реакци
Химические реакци Группа веществ, требующих особых методов изолирования. Характеристика соединений. Токсикологическое значение
Группа веществ, требующих особых методов изолирования. Характеристика соединений. Токсикологическое значение Презентация по Химии "Быль о каучуке"
Презентация по Химии "Быль о каучуке"  Презентация на тему Классы неорганических веществ
Презентация на тему Классы неорганических веществ  Решение задач с учетом примесей в веществе
Решение задач с учетом примесей в веществе Презентация на тему Окислительно – восстановительные реакции
Презентация на тему Окислительно – восстановительные реакции  Альдегиды, гомология, изомерия, номенклатура
Альдегиды, гомология, изомерия, номенклатура Презентация по Химии "Ароматические углеводороды в природе. Области их применения"
Презентация по Химии "Ароматические углеводороды в природе. Области их применения"  Выход продуктов пиролиза бензина
Выход продуктов пиролиза бензина ОГЭ химия. Основной государственный экзамен
ОГЭ химия. Основной государственный экзамен Валентность
Валентность Презентация по Химии "Схема получения моноизотопного кремния"
Презентация по Химии "Схема получения моноизотопного кремния"