Содержание
- 2. Нахождение металлов в природе
- 3. восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, алюминия и
- 4. Восстановление оксидом углерода (II) SnO2 + CO ? Восстановление алюминием или магнием Al + Fe2O3 ?
- 5. Восстановление металлов из солей в растворе. 2Na[Au(CN)2] + Zn ? Na2[Zn(CN)4] + 2Au (цианирование) СuSO4 +
- 6. Восстановление металлов при помощи электролиза. NaCl ? Al2O3 ? 3. Электрометаллургия
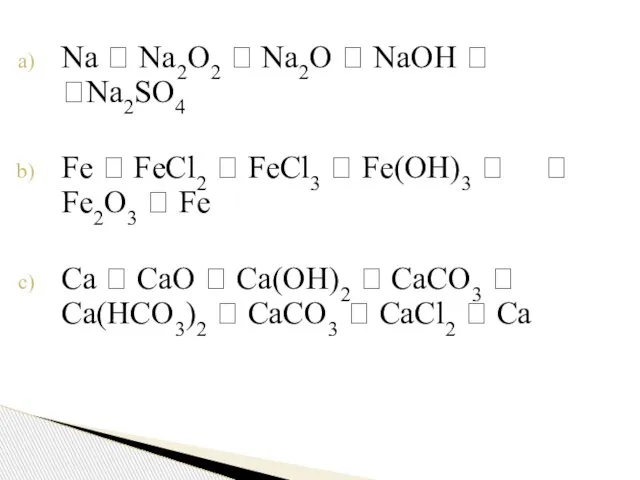
- 7. Na ? Na2O2 ? Na2O ? NaOH ? ?Na2SO4 Fe ? FeCl2 ? FeCl3 ? Fe(OH)3
- 9. Скачать презентацию



![Восстановление металлов из солей в растворе. 2Na[Au(CN)2] + Zn ? Na2[Zn(CN)4] +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/865868/slide-4.jpg)

 4. Диаграмма железо-углерод
4. Диаграмма железо-углерод Электролитическая диссоциация
Электролитическая диссоциация Химические свойства и получение насыщенных одноатомных спиртов
Химические свойства и получение насыщенных одноатомных спиртов Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6]
Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6] Кальций, железо. Горение стальной ваты и железного порошка
Кальций, железо. Горение стальной ваты и железного порошка Классификация неорганических веществ. Оксиды
Классификация неорганических веществ. Оксиды Решение задач на нахождение молекулярной формулы газообразного алкана
Решение задач на нахождение молекулярной формулы газообразного алкана Электролитическая диссоциация (9 класс)
Электролитическая диссоциация (9 класс) Металлы. Повторение
Металлы. Повторение Раздел 1
Раздел 1 Арены. Бензол
Арены. Бензол Презентация на тему Электролиз расплавов и растворов
Презентация на тему Электролиз расплавов и растворов  Портландцемент гидравликалық байланыстырғыш
Портландцемент гидравликалық байланыстырғыш Производные салициловой, пара-аминобензойной кислот, применяемые в медицине
Производные салициловой, пара-аминобензойной кислот, применяемые в медицине Количество вещества
Количество вещества Химия. Спирты
Химия. Спирты Химическая промышленность
Химическая промышленность Судын оксидтермен реакциясы
Судын оксидтермен реакциясы Типы кристаллических решеток
Типы кристаллических решеток Альдегиды и кетоны
Альдегиды и кетоны Презентация на тему Теория А. М. Бутлерова
Презентация на тему Теория А. М. Бутлерова  ОВР
ОВР Продолжение истории: 1933 год, Ленинград (Питер)
Продолжение истории: 1933 год, Ленинград (Питер) Первые попытки классификации химических элементов
Первые попытки классификации химических элементов Стехиометрические законы химии
Стехиометрические законы химии Углерод и его соединения
Углерод и его соединения Обобщение и повторение за курс основной школы по химии. 9 класс
Обобщение и повторение за курс основной школы по химии. 9 класс Три агрегатных состояния веществ
Три агрегатных состояния веществ