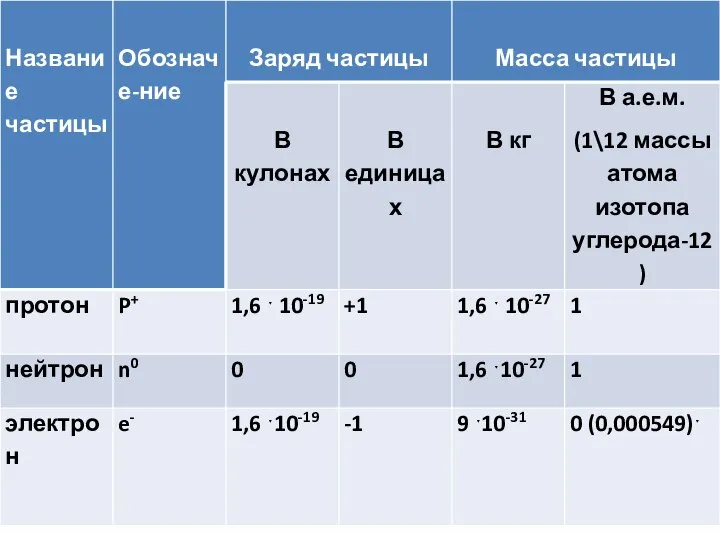
Слайд 3Число протонов как и число электронов в атоме определяется порядковым номером элемента

в периодической системе химических элементов. Число протонов определяет заряд ядра атома (обозначается Z). Количество нейтронов рассчитывается как разность между массовым числом атома и зарядом ядра (A-Z).
Совокупность атомов с определенным значением заряда ядра Z , массового числа A, называется нуклидом. Например: 37Cl, 15P.
Если атомы одного и того же элемента отличаются по массе, то они являются изотопами.
В атомах изотопов содержится разное количество нейтронов Например: 1H , 2H,3H – водород (H), дейтерий (D) и тритий (T).
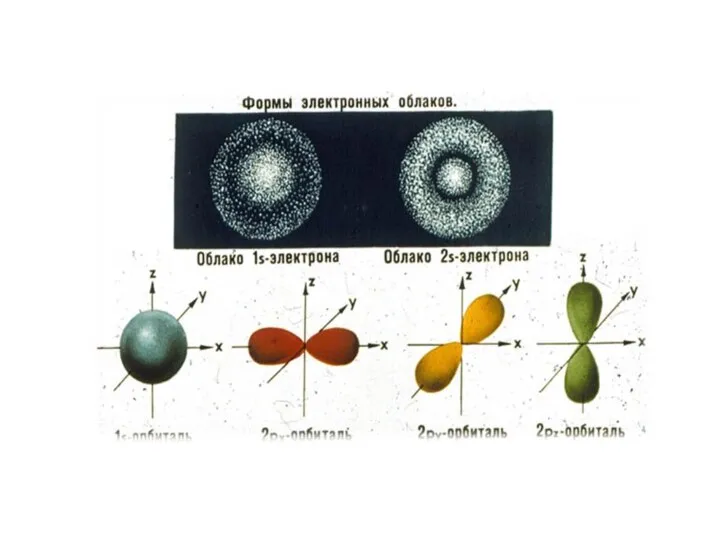
Слайд 4Понятие об электронном облаке
и s -,p -, d -, f- электронах
Область

пространства вокруг ядра, где наиболее вероятно нахождение электрона, называют атомной орбиталью. Атомные орбитали имеют различные формы, размеры и ориентацию в пространстве.
Слайд 6Состояние электронов в пространстве описывают с помощью четырех квантовых чисел.
Главное квантовое число

n – соответствует номеру энергетического уровня, на котором расположен электрон. (Количество энергетических уровней в атоме соответствует номеру периода, в котором расположен элемент.). Энергетический уровень – это совокупность энергетических состояний электрона в атоме, характеризующихся одним и тем же значением квантового числа n. Максимальное число электронов на каждом энергетическом уровне равно 2n2. Главное квантовое число принимает значения из множества натуральных чисел.
Слайд 7Орбитальное квантовое число l – определяет форму атомной орбитали. Принимает значения: для

s- орбитали= 0, для p-орбитали=1, для d =2, а для f =3 Орбитальное квантовое число принимает значения (n-l).
Совокупность орбиталей одной формы (с одинаковым значением орбитального квантового числа) на данном энергетическом уровне образует энергетический подуровень.
На основании математических расчетов определили, что электронные облака имеют следующую форму: s – орбиталь - форму сферы, р – орбиталь форму вытянутой восьмерки, формы d - и f - еще более сложные. На каждом энергетическом уровне (кроме первого) содержится несколько разных орбиталей. На первом уровне – одна - s. На втором - две- s и p . На третьем – три s,p,d. На четвертом – четыре s, p, d, f и т.д.
Слайд 8Строение
первых четырех энергетических уровней
Если электрон находится на s орбитали, то его
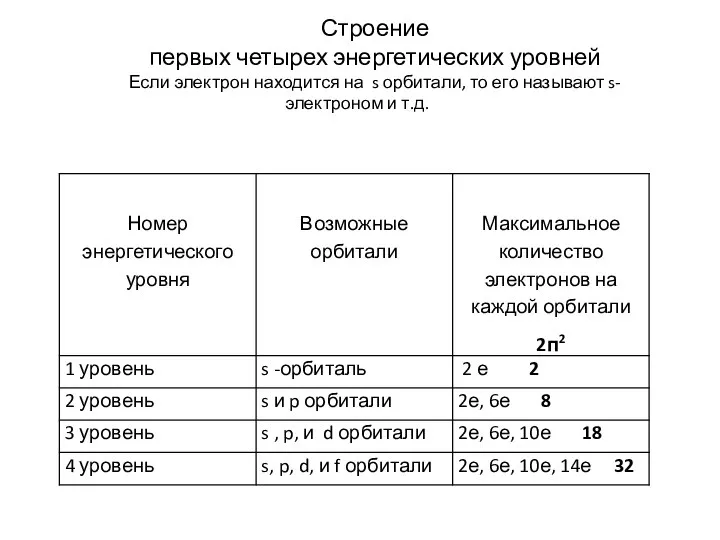
называют s- электроном и т.д.
Слайд 9Магнитное квантовое число ml – определяет ориентацию атомных орбиталей в пространстве.
Значение
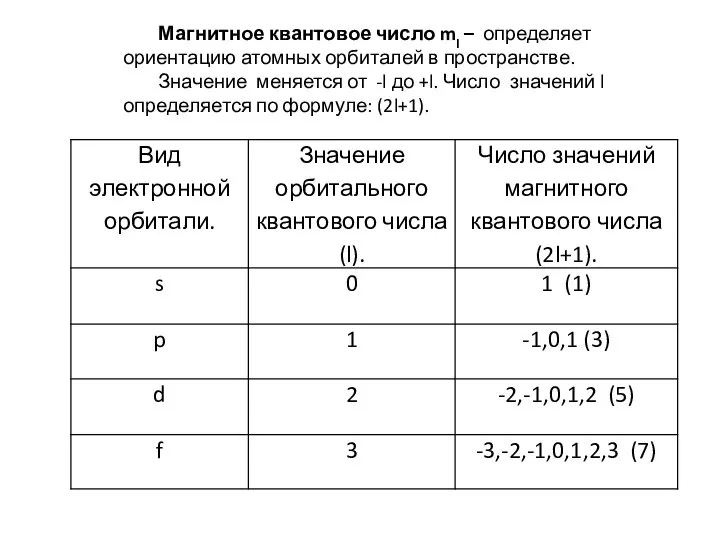
меняется от -l до +l. Число значений l определяется по формуле: (2l+1).
Слайд 10
Магнитное спиновое квантово число – ms - принимает два значения -1\2 и

+1\2.
На каждой орбитали могут одновременно находиться не более двух электронов, они будут отличаться друг от друга значением спинового квантового числа.
Слайд 11Принцип заполнения электронами атомных орбиталей подчиняется запрету Паули: в атоме не может

быть двух электронов с одинаковым значением всех четырех квантовых чисел, т.е. в атоме не может быть электронов, которые находились бы в одинаковом квантовом состоянии.
Правило Хунда: Наиболее устойчивым состоянием является такое, при котором будет максимально возможное число неспаренных электронов на каждом из подуровней.
Слайд 12Строение электронных оболочек описывают с помощью электронных формул, ее также называют электронной

конфигурацией. Заполнение электронами электронных оболочек подчиняется правилу Хунда и правилу Клечковского.
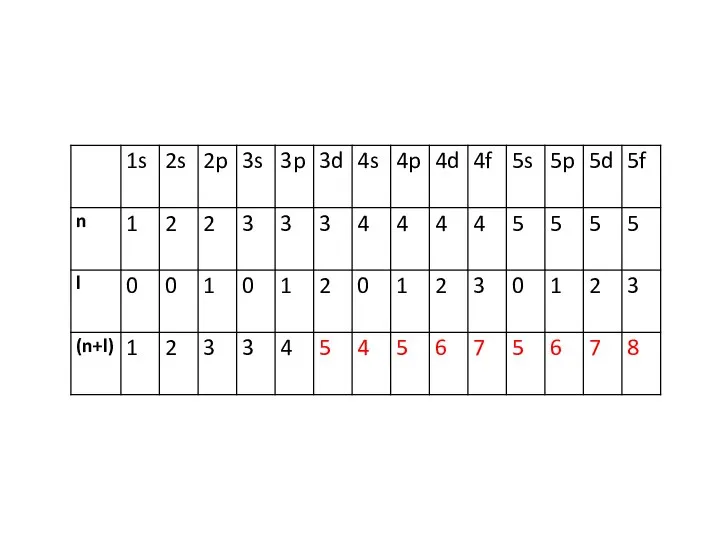
В соответствии с правилом Клечковского атомные орбитали заполняются электронами в порядке плавного возрастания суммы (n+l). При одинаковых значениях (n+l) сначала заполняются орбитали с наименьшим значением n.
Слайд 14Таким образом, электронная конфигурация будет иметь вид:
1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d и т.д.
Примеры:
S 1s22s22p63s23p4 p –

элемент (т.к. последней заполняемой орбиталью является p-орбиталь);
Ca 1s22s22p63s23p64s2 s – элемент;
V 1s22s22p63s23p64s43d3 d – элемент;
Pr 1s22s22p63s23p64s43d104p65s24d105p66s24f35d0 f - элемент
Слайд 15Радиус атома.
Радиус атома – половина межъядерного расстояния в молекулах простых и сложных

веществ в среднем достигают 10-10м.
По периоду радиус атома немонотонно уменьшается. С увеличением заряда ядра атома число энергетических уровней остается постоянным. Т.о. электронная оболочка испытывает более сильное притяжение ядра, которое приводит к сжатию атома, т.е. уменьшению радиуса.
В главных подгруппах радиус атома увеличивается. По мере увеличения номера периода происходит увеличение заполняющихся электронами уровней.
Слайд 16Основное и возбужденное состояние атома.
Основное состояние атома – это то состояние, которое

следует при составлении электронной конфигурации с учетом принципа минимума энергии, когда каждый электрон стремиться занять положение ближайшее к ядру. Для объяснения валентных возможностей атома элемента иногда прибегают к понятию возбужденного состояния атома. При этом происходит распаривание общих электронных пар, расположенных на валентном уровне и перевод электронов на другую валентную орбиталь. Пример обозначения состояния атома: основное возбужденное, C C*
Слайд 18
Задания для тренировки
1.Изобразить электронные конфигурации атомов, указать тип элемента:
Натрий, сера, фосфор, титан,

гелий.
Серебро, селен, марганец, углерод, аргон.
Ванадий, скандий, теллур, цезий, криптон
2.По электронной конфигурации определите о каком элементе идет речь:
1S22S22P5;
1S22S22P63S23P64S1;
1S22S22P63S23P64S2 3D10 4P5.
3s23p2
4s23d3
4f35d06s2
5s24d2
3.Почему в атомах следующих элементов происходит «проскок» электрона? Напишите электронные конфигурации атомов следующих элементов и объясните этот эффект:
Cr, Ag, Mo, Pd
Слайд 194.Почему в атомах следующих элементов вопреки ожиданию не происходит «проскока» электрона?
W,

Pt
5.Могут ли атомы в основном (не в возбужденном) состоянии иметь следующие конфигурации:
2s22p3
3s23p53d1
3s23p33d1
4s14p33d2
6.Какие частицы могут иметь следующие конфигурации:
3s23p6
4s2
3s2
2s22p2
Слайд 207.Какие, из приведенных ниже частиц, могут иметь одинаковые конфигурации: P5+; F-; S2-;

Al0; K+; Ti4+; C4+; Na+; Si4+; N3-; Cu2+?
8.Можно ли считать, что S0 и S2- одна и та же частица? Объясните свою точку зрения, составив электронные конфигурации.
9.Можно ли считать, что Cl- и Ar0 абсолютно одинаковые частицы? Объясните свою точку зрения, приведя необходимые расчеты.
Слайд 2110.Числа 35 и 17 в обозначении атома 17 35Cl показывают...
число протонов и

число нейтронов
массовое число и заряд ядра
атомную массу и порядковый номер хлора
общее число электронов и число валентных электронов в атоме
11.Главное квантовое число характеризует…
молекулярную орбиталь
ориентацию орбитали в пространстве
число электронов в атоме
общую энергию электрона
Слайд 2212.Распределение электронов по орбиталям в основном состоянии атома определяется…
принципом запрета Паули
правилом Хунда
принципом

наименьшей энергии
всеми перечисленными выше принципами
13.Укажите, в каком из случаев орбитали перечислены в порядке увеличения их энергии:
2s,2p,2d
3s,3p,3d
4f,5s,6d
3p,3d,3f
Слайд 2314. Сколько электронов находится на 2p -подуровне в основном состоянии атома азота?
7
5
3
1
15.

Какую из перечисленных электронных конфигураций может иметь атом хлора?
1s22s22p5
1s22s22p63s23p44p1
1s22s22p63s23p6
1s22s22p63s23p54s1
Слайд 24Тестовые задания
1. Число протонов, нейтронов и электронов в атоме изотопа 90Sr соответственно

равно
38, 90, 38
38, 52, 38
90, 52, 38
38, 52, 90
2. Инертный газ, имеющий такую же электронную конфигурацию, что и ион K+
Ne
Ar
Cl
Kr
3. Частица, имеющая такую же электронную конфигурацию, что и атом Kr, это
Se2-
Br+5
S2-
Ar0
Слайд 254. Ионы, имеющие такую же электронную конфигурацию, что и атом аргона, это
K+

и S2-
K+ и Na+
Al3+ и S2-
Na+ и Al3+
5. Электронная формула меди
1s22s22p63s23p63d94s2
1s22s22p6 3s23p63d104s1
1s22s22p6 3s23p63d34s24p6
1s22s22p6 3s23p63d104s2
6. Какой ряд не содержит d-элементов
Марганец, тантал, сера, углерод
Азот, натрий, аргон, йод
Вольфрам, железо, цинк, лантан
Хром, цезий, франций, бром
Слайд 267. Заряд иона, образующегося в результате удаления всех валентных электронов атома с

электронной конфигурацией 1s22s22p63s23p63d104s1 , равен
+14
+1
+5
+6
8. Суммарное число электронов в частице NO2- равно
22
23
24
25
9. 16 электронов содержит частица
Cl-
S2-
O0
S0
Слайд 2710. Число нейтронов в атоме 39К равно числу нейтронов в атоме
39Ar
40Ca

35Cl
40Ar
11. Число протонов в атоме 39К равно
39
20
19
4
12. Число электронов внешнего электронного слоя для атома кислорода равно
2
4
6
8
Слайд 2813. Не отвечает формуле 2s22p6 строение внешнего электронного слоя частицы
F-
Mg2+
Na+
O0
14. Число

неспаренных электронов атома углерода в возбужденном состоянии равно
1
2
3
4
15. Число нейтронов в ядре атома 31Р равно
5
15
16
31
Слайд 2916. 20 нейтронов содержит атом
39K
42Ca
20Ne
10B
17. В четвертом электронном слое содержит 5 электронов

атом
V
As
Sn
Zr
18. Электронную конфигурацию внешнего электронного слоя 4s24p3 имеет атом
As
Ga
Sc
V
























 Тема: Неметаллы
Тема: Неметаллы Физические величины для подсчета числа частиц вещества
Физические величины для подсчета числа частиц вещества Гидролиз солей
Гидролиз солей Неорганические вещества
Неорганические вещества Химические свойства воды
Химические свойства воды Анализ катионов и анионов. Лекция № 2
Анализ катионов и анионов. Лекция № 2 Техника безопасности при использовании различных видов топлива. Практическая работа № 3
Техника безопасности при использовании различных видов топлива. Практическая работа № 3 Сложные эфиры. Организация внеаудиторной творческой работы учащихся
Сложные эфиры. Организация внеаудиторной творческой работы учащихся Реакции ионного обмена составление ионных уравнений
Реакции ионного обмена составление ионных уравнений Научный эксперимент в химической технологии
Научный эксперимент в химической технологии Ковалентная полярная связь
Ковалентная полярная связь Оценивание эффективности многофункциональной присадки для бензинов
Оценивание эффективности многофункциональной присадки для бензинов Химические свойства алканов. Алканы
Химические свойства алканов. Алканы Презентация на тему Хлор - физиологическая и патологическая роль в организме человека
Презентация на тему Хлор - физиологическая и патологическая роль в организме человека  Алкины
Алкины Кислоты, их состав и название
Кислоты, их состав и название Презентация на тему Атомы и молекулы
Презентация на тему Атомы и молекулы  Полезные ископаемые
Полезные ископаемые Неорганические основания
Неорганические основания Арены. Ароматические углеводороды
Арены. Ароматические углеводороды Строение атома. Связь основных характеристик атома с его положением в таблице Д.И. Менделеева. Способы изображения строения
Строение атома. Связь основных характеристик атома с его положением в таблице Д.И. Менделеева. Способы изображения строения Презентация на тему Фосфор 9 класс
Презентация на тему Фосфор 9 класс  Предельные одноосновные карбоновые кислоты. Сложные эфиры
Предельные одноосновные карбоновые кислоты. Сложные эфиры Вода знакомая и не знакомая
Вода знакомая и не знакомая Физическая и коллоидная химия
Физическая и коллоидная химия Соли. Формула соли
Соли. Формула соли Стирол - важнейшее производное бензола
Стирол - важнейшее производное бензола Premeny látok. Horenie ako chemická reakcia
Premeny látok. Horenie ako chemická reakcia