Содержание
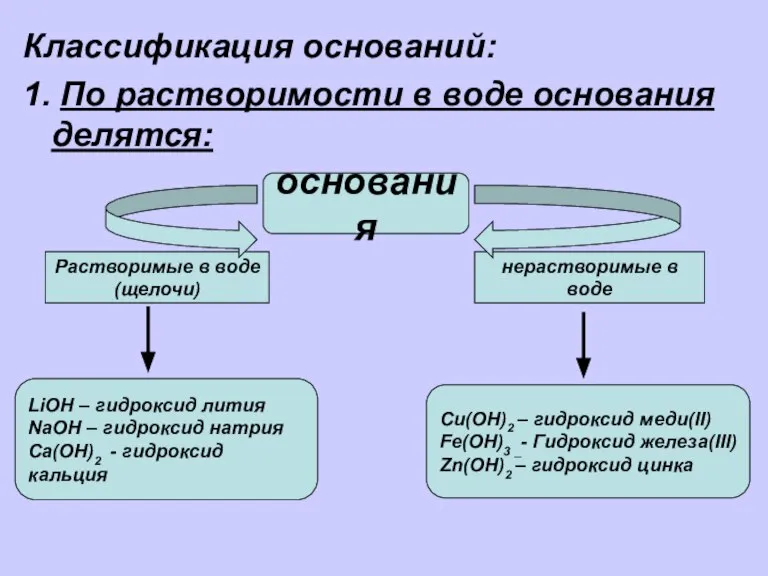
- 2. Классификация оснований: 1. По растворимости в воде основания делятся: основания Растворимые в воде (щелочи) нерастворимые в
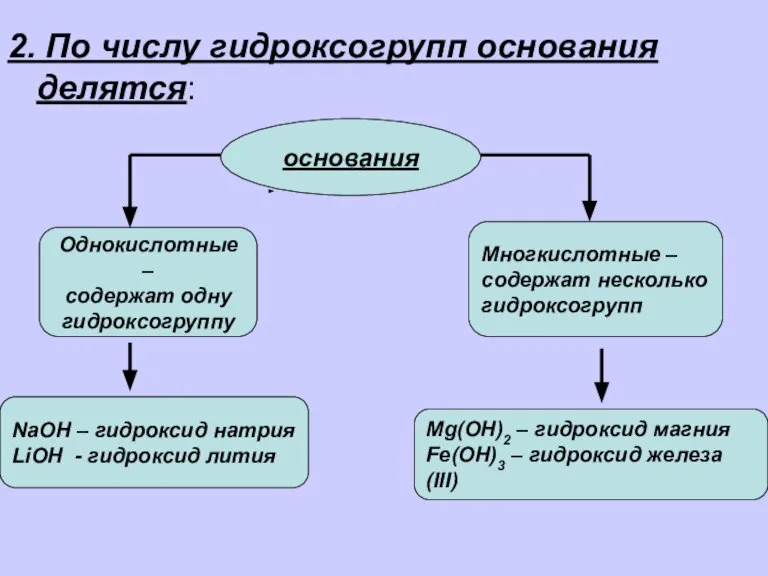
- 3. 2. По числу гидроксогрупп основания делятся: основания Однокислотные – содержат одну гидроксогруппу Многкислотные – содержат несколько
- 4. I. Получение растворимых оснований 1. Взаимодействие активных металлов (Li, Na, K, Rb, Cs, Fr, Ca, Sr,
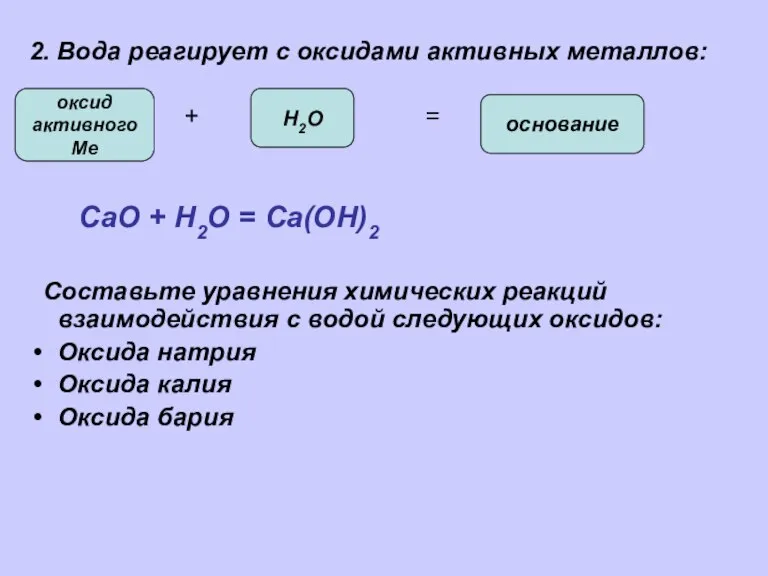
- 5. 2. Вода реагирует с оксидами активных металлов: + = СаО + Н2О = Са(ОН)2 Составьте уравнения
- 7. Скачать презентацию

 Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения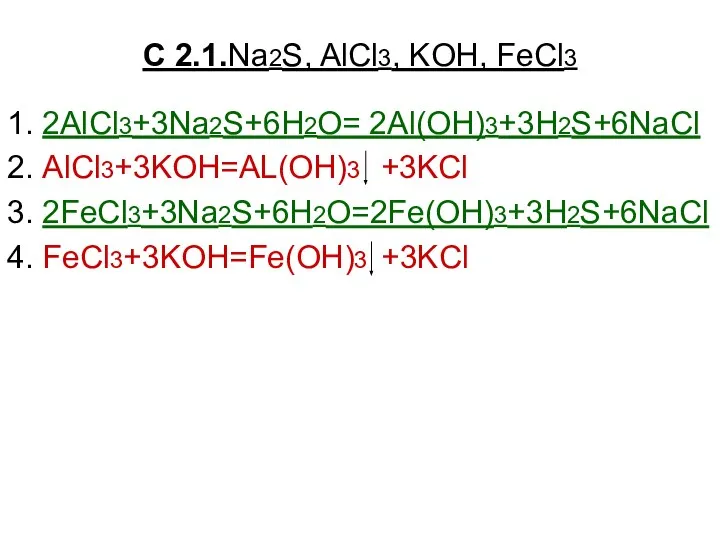 Na2S, AlCl3, KOH, FeCl3
Na2S, AlCl3, KOH, FeCl3 Основания, их состав и название
Основания, их состав и название Обобщение и систематизация знаний по теме Вещества и их классификация
Обобщение и систематизация знаний по теме Вещества и их классификация Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Кислородные соединения углерода
Кислородные соединения углерода Подготовка к ГИА 2021
Подготовка к ГИА 2021 Автомобильные бензины. Свойства топлив
Автомобильные бензины. Свойства топлив Практические занятия по теме: Методы защиты энергооборудования от коррозии (1)
Практические занятия по теме: Методы защиты энергооборудования от коррозии (1)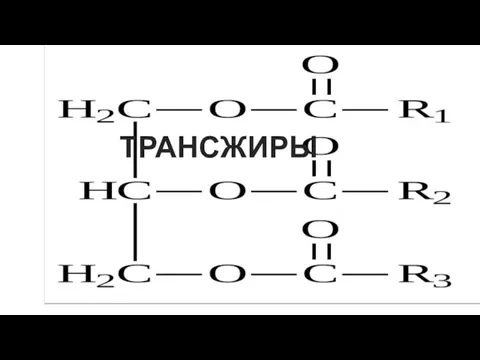 Трансжиры и их анализ
Трансжиры и их анализ Чистые вещества и смеси. Классификация веществ. Оксиды
Чистые вещества и смеси. Классификация веществ. Оксиды Неметаллы
Неметаллы Электролиз. Применение электролиза
Электролиз. Применение электролиза Презентация на тему Химия и повседневная жизнь человека
Презентация на тему Химия и повседневная жизнь человека  Развитие энергетики и проблемы изменения структуры использования углеводородного сырья
Развитие энергетики и проблемы изменения структуры использования углеводородного сырья Суд над химическим элементом Углерод
Суд над химическим элементом Углерод Уретановый каучук
Уретановый каучук Обращеннофазовая хроматография высокого разрешения RP HPLC
Обращеннофазовая хроматография высокого разрешения RP HPLC Химия вокруг нас
Химия вокруг нас Жиры (липиды)
Жиры (липиды) Проект синтеза бензина для промышленных целей отделения Д-3 цеха Д 2-6-3-5-12
Проект синтеза бензина для промышленных целей отделения Д-3 цеха Д 2-6-3-5-12 Важнейшие классы бинарных соединений – оксиды и летучие водородные соединения
Важнейшие классы бинарных соединений – оксиды и летучие водородные соединения Трансляция. Активирование аминокислоты
Трансляция. Активирование аминокислоты Валентность. Порядок действий при составлении химической формулы
Валентность. Порядок действий при составлении химической формулы Презентация на тему Роль органической химии в жизни человека
Презентация на тему Роль органической химии в жизни человека  Презентация на тему Самородки 9 класс
Презентация на тему Самородки 9 класс  Химия и сельское хозяйство
Химия и сельское хозяйство Кремний. Технический кремний
Кремний. Технический кремний