Содержание
- 2. Классификация буферных систем.
- 3. Буферная емкость. Буферная емкость раствора характеризует способность буферного раствора поддерживать постоянное значение pH при добавлении кислоты
- 4. НВ ↔ Н+ + В- Слабая кислота ↔ протон + сопряженное с кислотой основание По закону
- 5. Пример поиска pH буферного раствора. СН3СООН + СН3СООK 30 мл 0.1М 50 мл 0.3М Kа =
- 6. Пример поиска буферной емкости. 1 моль HCOOH 1 моль HCOONa по отношению к HCl и NaOH
- 8. Скачать презентацию





 Создание теплостойких эластомерных материалов на основе фторкаучуков
Создание теплостойких эластомерных материалов на основе фторкаучуков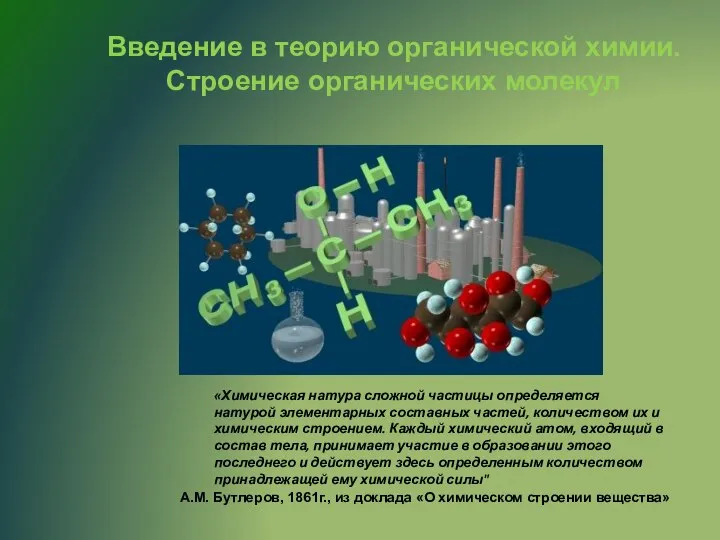 Строение органических молекул. (Лекция 2)
Строение органических молекул. (Лекция 2) Положение металлов в периодической системе химических элементов
Положение металлов в периодической системе химических элементов Презентация на тему Ферменты и гормоны
Презентация на тему Ферменты и гормоны  Состав и значение воздуха
Состав и значение воздуха Фенолы. Классификация
Фенолы. Классификация Презентация на тему Классификация полимеров
Презентация на тему Классификация полимеров  Кислота
Кислота Л-1-5
Л-1-5 Путешествие в страну Нефтехимия
Путешествие в страну Нефтехимия Химия дома
Химия дома Электроотрицательность (ЭО)
Электроотрицательность (ЭО) ЕГЭ по химии: документы, регламентирующие структуру и содержание контрольных измерительных материалов
ЕГЭ по химии: документы, регламентирующие структуру и содержание контрольных измерительных материалов Теория валентных связей
Теория валентных связей Химическая промышленность. 9 класс
Химическая промышленность. 9 класс Липиды молока и молочных продуктов. Группы липидов
Липиды молока и молочных продуктов. Группы липидов Таблица Д.И. Менделеева
Таблица Д.И. Менделеева Аминокислоты. Классификация, номенклатура
Аминокислоты. Классификация, номенклатура Дисперсные системы
Дисперсные системы Азот
Азот Презентация на тему Вода – растворитель
Презентация на тему Вода – растворитель  Сера и его соединения
Сера и его соединения Термодинамическая теория растворов электролитов. Электропроводность растворов электролитов
Термодинамическая теория растворов электролитов. Электропроводность растворов электролитов Классификации по атомному весу
Классификации по атомному весу Обмен углеводов
Обмен углеводов Алкены
Алкены Analoghi nucleobasi
Analoghi nucleobasi Липиды. Омыляемые липиды. Рубежный контроль №2
Липиды. Омыляемые липиды. Рубежный контроль №2