Содержание
- 2. Значения рН различных систем организма Сыворотка крови − 7,35 – 7,45 Спинно-мозговая жидкость − 7,35 –
- 3. Буферные системы крови
- 4. Уравнение буферных систем ( Гендерсона – Гассельбаха ) Н2СО3 Н+ + НСО3- КН2СО3 = [ Н2СО3
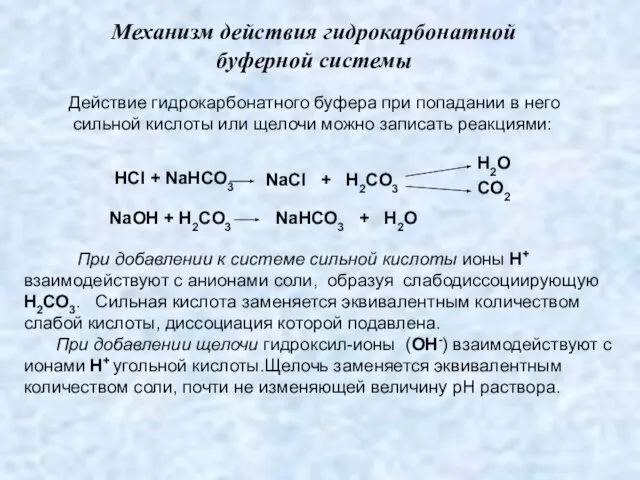
- 5. Механизм действия гидрокарбонатной буферной системы Действие гидрокарбонатного буфера при попадании в него сильной кислоты или щелочи
- 6. мембрана О2 СО2 Механизм действия гемоглобинового буфера мембрана
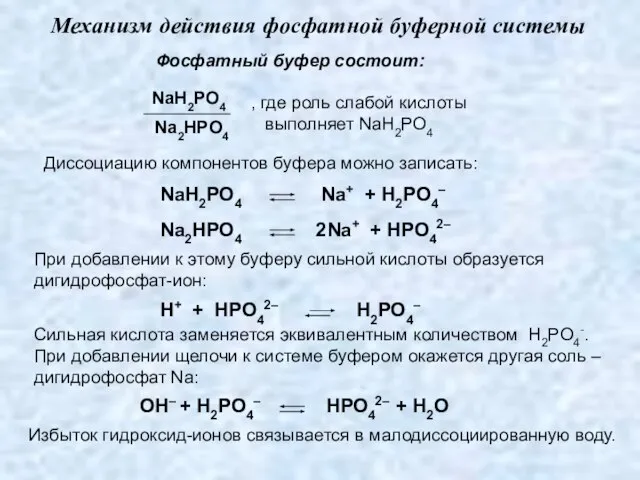
- 7. Механизм действия фосфатной буферной системы Фосфатный буфер состоит: NaH2PO4 Na2HPO4 , где роль слабой кислоты выполняет
- 9. Скачать презентацию




 Хроматография
Хроматография Геометрия молекул
Геометрия молекул Синтез макромолекул
Синтез макромолекул Простое вещество и химический элемент азот
Простое вещество и химический элемент азот Расчет энергетического профиля реакции N,N,N’,N’-тетраметилгуанидина с о-метиленхиноном
Расчет энергетического профиля реакции N,N,N’,N’-тетраметилгуанидина с о-метиленхиноном Разбор контрольной работы. Химия (9 класс)
Разбор контрольной работы. Химия (9 класс) Вывод формул химических веществ
Вывод формул химических веществ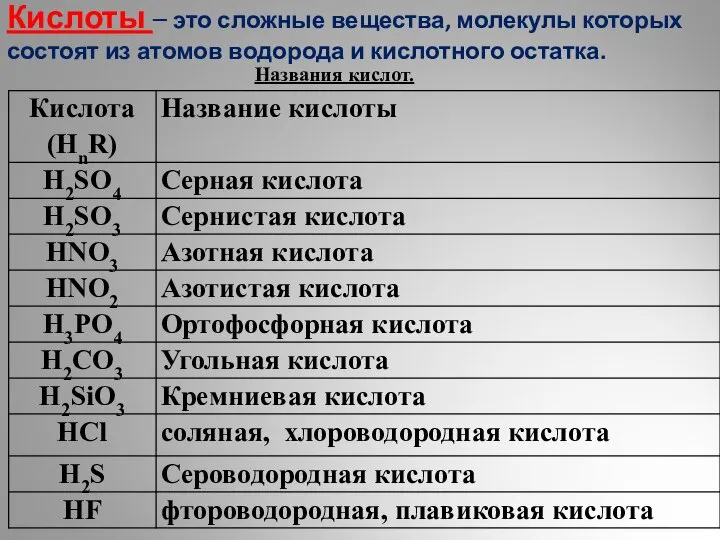 Кислоты. Классификация
Кислоты. Классификация Химическая кинетика. Экзаменационные вопросы
Химическая кинетика. Экзаменационные вопросы Презентация на тему Интересные факты из жизни великого учёного Д. И. Менделеева
Презентация на тему Интересные факты из жизни великого учёного Д. И. Менделеева  Карбонат натрия
Карбонат натрия Электролиты. Химический диктант (9 класс)
Электролиты. Химический диктант (9 класс) Декоративная краска с эффектом окисленной меди
Декоративная краска с эффектом окисленной меди Характеристика 1-й аналитической группы анионов
Характеристика 1-й аналитической группы анионов Очистка поваренной соли методом кристаллизации в домашних условиях
Очистка поваренной соли методом кристаллизации в домашних условиях Презентация на тему Задачи на смеси и сплавы (9 класс)
Презентация на тему Задачи на смеси и сплавы (9 класс)  Химические свойства классов неорганических соединений
Химические свойства классов неорганических соединений Полистирол. Оформление мини-реферата по химии
Полистирол. Оформление мини-реферата по химии Алкины
Алкины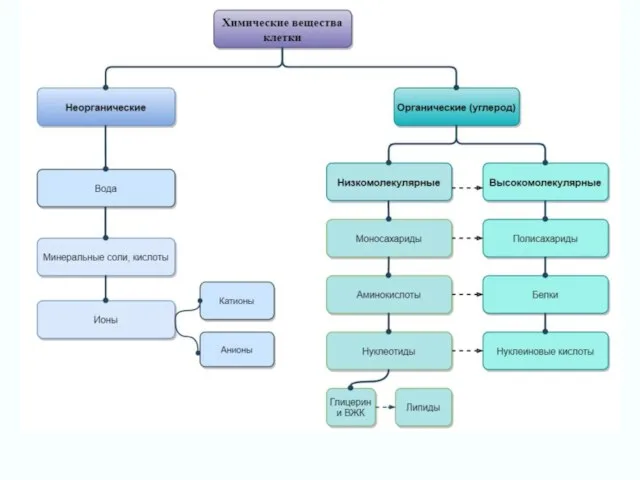 Химические элементы
Химические элементы 11 класс 15.09
11 класс 15.09 Специальные виды перегонки
Специальные виды перегонки Адсорбционные материалы. Цеолиты
Адсорбционные материалы. Цеолиты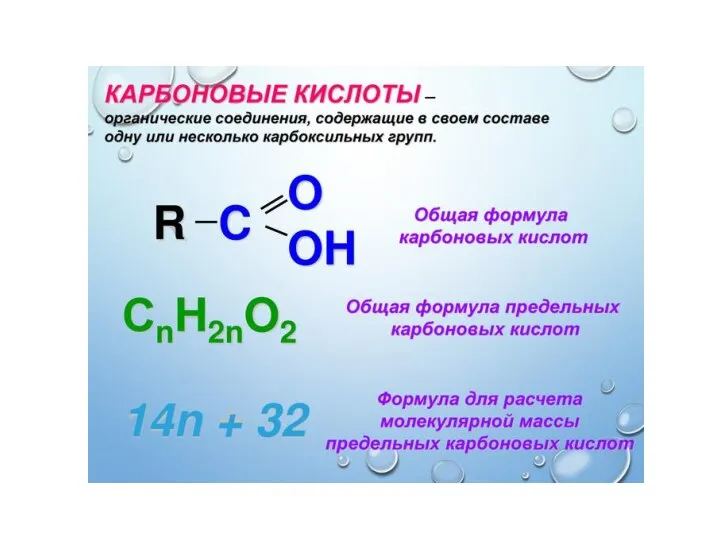 Карбоновые кислоты
Карбоновые кислоты О некоторых удивительных удивительных свойствах свойствах веществ
О некоторых удивительных удивительных свойствах свойствах веществ Электролитическая диссоциация
Электролитическая диссоциация Development of the system of concepts on the topic redox reactions in the school course of inorganic chemistry
Development of the system of concepts on the topic redox reactions in the school course of inorganic chemistry Сера и её соединения
Сера и её соединения