Содержание
- 2. Сформировать понятия об электролитах и неэлектролитах. 2. Рассмотреть механизм диссоциации веществ с ковалентной полярной и ионной
- 3. Самостоятельная работа 1 вариант В 50 г воды растворили 50 г щелочи. Вычислите массу полученного раствора
- 4. Из истории ЭЛД Еще в начале XIX в. ученые сделали важное наблюдение: электрический ток могут проводить
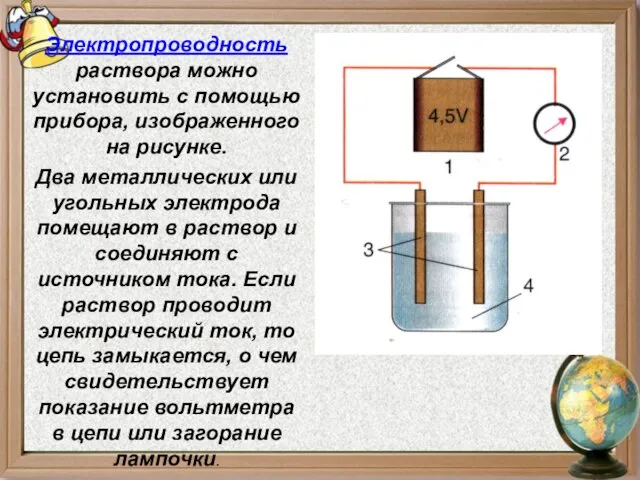
- 5. Электропроводность раствора можно установить с помощью прибора, изображенного на рисунке. Два металлических или угольных электрода помещают
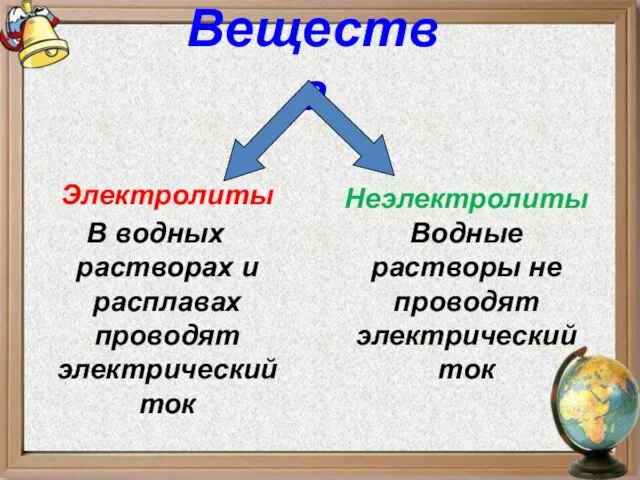
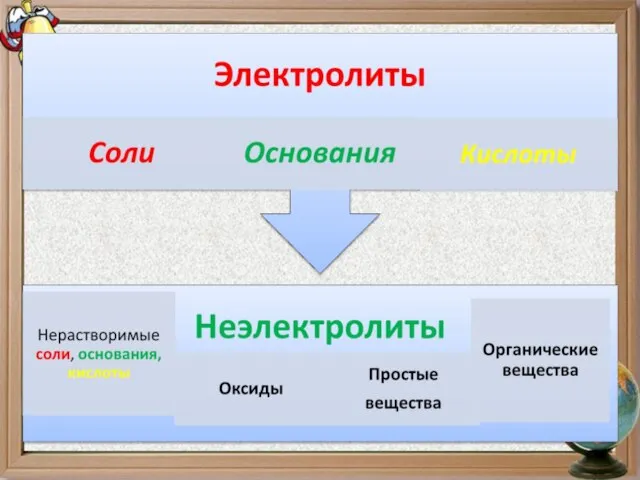
- 6. Электролиты В водных растворах и расплавах проводят электрический ток Вещества Неэлектролиты Водные растворы не проводят электрический
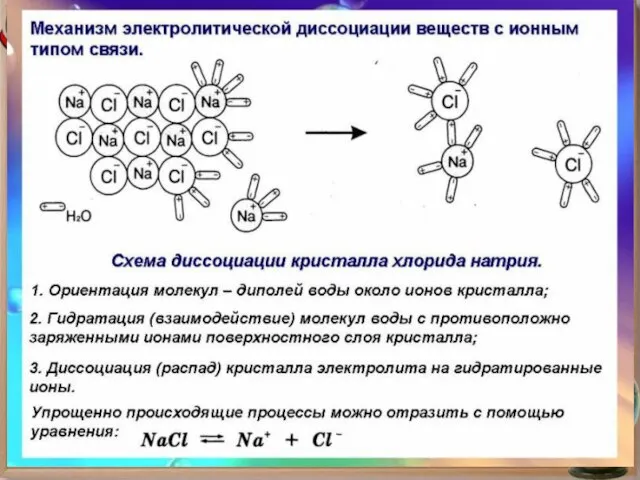
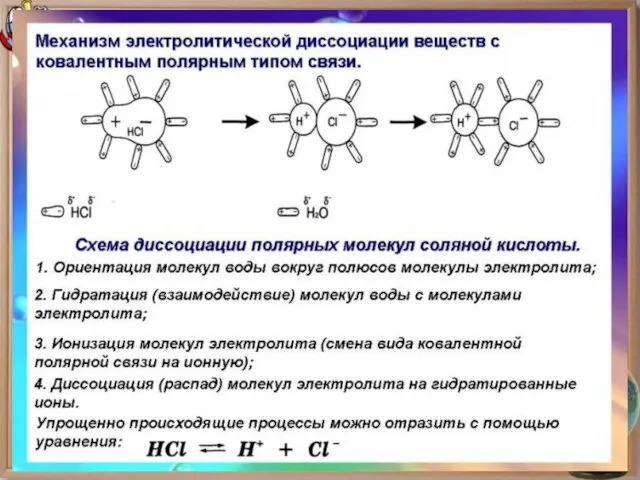
- 8. Для объяснения особого поведения электролитов в растворах и расплавах шведский ученый С. Аррениус в 1887 г.
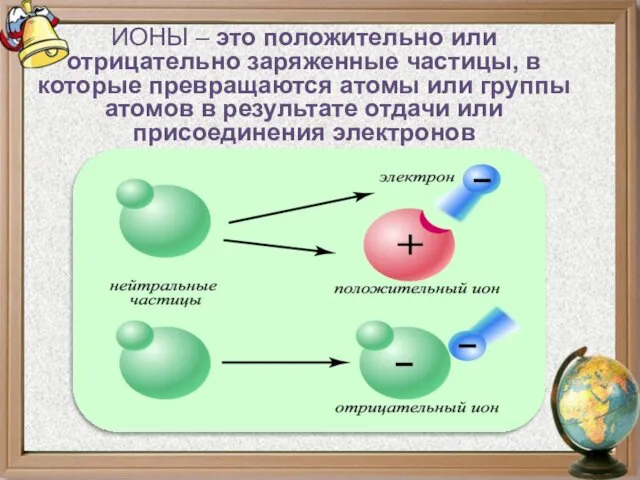
- 9. ИОНЫ – это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов в
- 10. Виды связи в соединениях Ковалентная ( полярная и неполярная) - это связь, образованная с помощью общих
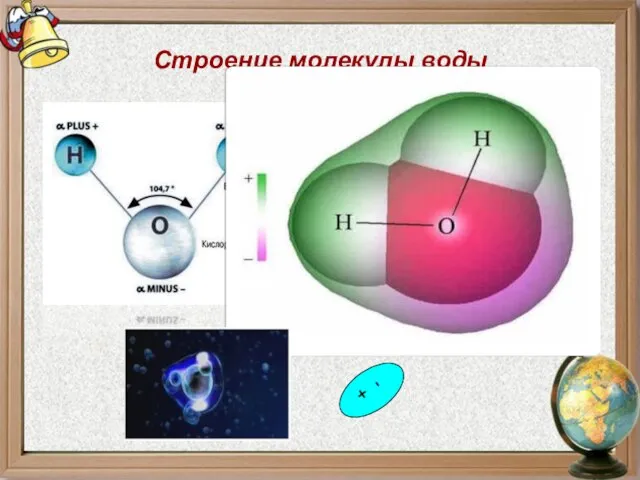
- 11. Строение молекулы воды - +
- 14. Степень диссоциации (α) – это отношение числа частиц, распавшихся на ионы (Nд), к общему числу растворенных
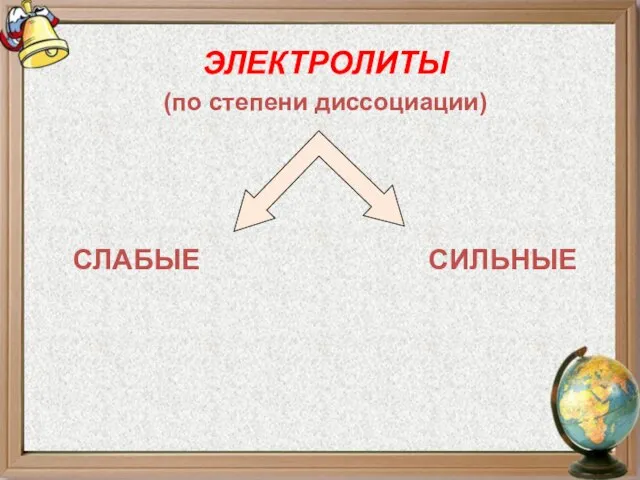
- 15. ЭЛЕКТРОЛИТЫ (по степени диссоциации) СЛАБЫЕ СИЛЬНЫЕ
- 16. Сила электролитов
- 18. Скачать презентацию







 Карбоцепные полимеры
Карбоцепные полимеры 9-14 Реакции в растворах электролитов
9-14 Реакции в растворах электролитов Презентация на тему Химические свойства оксидов
Презентация на тему Химические свойства оксидов  Химическое равновесие
Химическое равновесие Калийные удобрения. Лекция 28
Калийные удобрения. Лекция 28 Ovr-1
Ovr-1 Металлургия
Металлургия Теория строения органических соединений
Теория строения органических соединений Предмет химии. Вещества
Предмет химии. Вещества Основы химии полимеров
Основы химии полимеров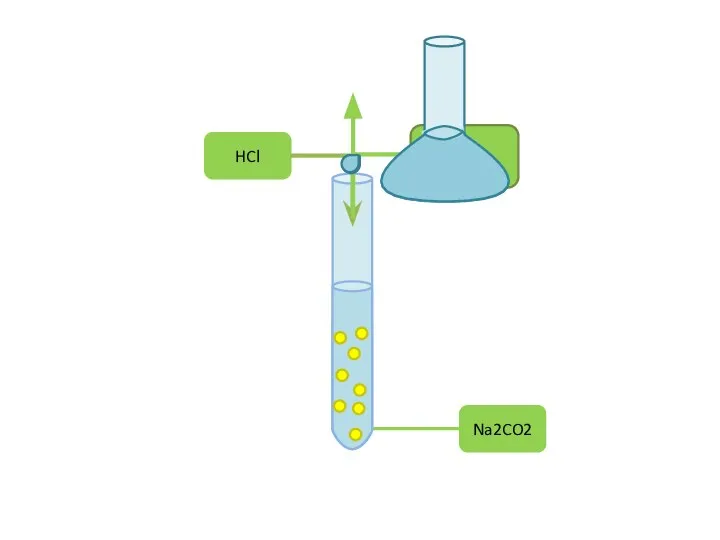 Хімічний експеримент
Хімічний експеримент Теплота растворения
Теплота растворения Арены. Бензол
Арены. Бензол 8_ANIONY_2_3_angr
8_ANIONY_2_3_angr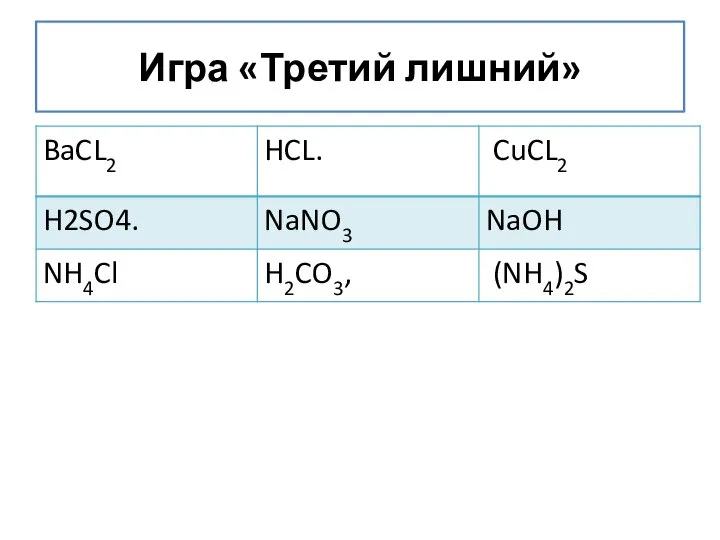 Аммиак. Соли аммония
Аммиак. Соли аммония Альдегиды и кетоны
Альдегиды и кетоны Кислоты. К уроку по химии для 8 класса
Кислоты. К уроку по химии для 8 класса Растворение веществ в воде. Лабораторный опыт № 5 Изучение растворимости веществ
Растворение веществ в воде. Лабораторный опыт № 5 Изучение растворимости веществ Образование химических связей
Образование химических связей Презентация на тему Арены (10 класс)
Презентация на тему Арены (10 класс)  Харктеристика металлов
Харктеристика металлов Презентация на тему Сложные вопросы ЕГЭ по химии
Презентация на тему Сложные вопросы ЕГЭ по химии  Валентность
Валентность Substanță chimică
Substanță chimică Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов Органическая химия. Классификация. Номенклатура
Органическая химия. Классификация. Номенклатура Неметаллические материалы
Неметаллические материалы Растворы и их концентрация. Массовая доля растворенного вещества
Растворы и их концентрация. Массовая доля растворенного вещества