Слайд 2ЛЕКЦИЯ №7
ДИСПЕРСНЫЕ СИСТЕМЫ
ОП. 05 Химия
1 курс 1 семестр
Составитель: преподаватель
Кобзева Марина

Валерьевна
Ставрополь, 2020г
Слайд 3 Дисперсная система — это система, образованная из двух или более фаз (тел),

которые совершенно или практически не смешиваются и не реагируют друг с другом химически.
Первое из веществ (дисперсная фаза) мелко распределено во втором (дисперсионная среда). Если фаз несколько, их можно отделить друг от друга физическим способом (центрифугировать, сепарировать и т. д.).
Обычно дисперсные системы — это коллоидные растворы, золи.
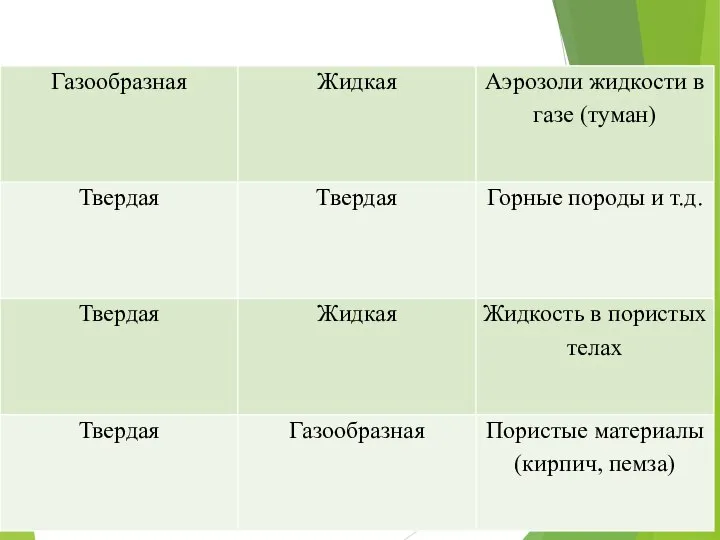
Слайд 4Основные типы дисперсных систем.
По дисперсности, т. е. размеру частиц дисперсной фазы

или отношению общей площади межфазной поверхности к объему (или массе) дисперсной фазы (удельная поверхности). Дисперсные системы условно делят на грубодисперсные и тонкодисперсные (коллоидные системы).
Слайд 5 От степени дисперсности зависят свойства дисперсных систем, в частности их устойчивость. Грубодисперсные

системы являются неустойчивыми и со временем разделяются на дисперсную фазу и дисперсную среду. Коллоиднодисперсные системы значительно более устойчивы.
В природе и технике часто встречаются дисперсные системы, в которых одно вещество равномерно распределено в виде частиц внутри другого вещества
Слайд 6В зависимости от агрегатного состояния дисперсионной среды и дисперсной фазы выделяют основные

виды дисперсных систем
Слайд 8КОЛЛОИДНЫЕ СИСТЕМЫ
Коллоидные растворы - это высокодисперсные двухфазные системы, состоящие из дисперсионной среды

и дисперсной фазы, причем линейные размеры частиц последней лежат в пределах от 1 до 100 нм.
Как видно, коллоидные растворы по размерам частиц являются промежуточными между истинными растворами и суспензиями и эмульсиями.
Коллоидные частицы обычно состоят из большого числа молекул или ионов. Коллоидные частицы называют мицеллами.
Слайд 9 Строение мицеллы рассмотрим на примере образования коллоидного раствора йодида серебра, получаемого при

взаимодействии очень разбавленных растворов нитрата серебра и йодида калия:
AgNO3+KI = AgI↓+KNO3
Ag++No3- +K++I-=AgI↓+K++NO3-
Слайд 10 Нерастворимые молекулы йодида серебра образуют ядро коллоидной частицы. Вещество ядра, имеющее кристаллическую

или аморфную структуру, нерастворимо в дисперсионной среде и состоит из нескольких тысяч нейтральных молекул или атомов.
Полученное ядро адсорбирует на своей поверхности те или иные ионы, имеющиеся в растворе. Если коллоидный раствор получают при избытке йодида калия, то адсорбируются ионы йода.
Они достраивают кристаллическую решетку ядра, прочно входят в его структуру, образуя адсорбционный слой, и придают ядру отрицательный заряд.
Слайд 11 Коллоидные растворы иначе называют золями. Их получают дисперсионными и кондесационными методами.
Диспергирование

чаще всего производят при помощи особых «коллоидных мельниц».
При конденсационном методе коллоидные частицы образуются за счет объединения атомов или молекул в агрегаты.
При протекании многих химических реакций происходит конденсация и образуются высокодисперсные системы (выпадение осадков, протекание гидролиза, окислительно-восстановительные реакции и т.д.).
1 нм - нанометр (1 нм = 10-9 м).
Слайд 12 В отличие от истинных растворов для золей характерен эффект Тиндаля, т. е.

рассеяние света коллоидными частицами.
При пропускании через золь пучка света появляется светлый конус, видимый в затемненном помещении .
Так можно распознать, является данный раствор коллоидным или истинным.
Слайд 13 Одним из важных свойств золей является то, что их частицы имеют электрические

заряды одного знака.
Благодаря этому они не соединяются в более крупные частицы и не осаждаются. При этом частицы одних золей, например металлов, сульфидов, кремниевой и оловянной кислот, имеют отрицательный заряд, других, например гидроксидов, оксидов металлов, — положительный заряд.
Возникновение заряда объясняется адсорбцией коллоидными частицами ионов из раствора
Слайд 14 Для осаждения золя необходимо, чтобы его частицы соединились в более крупные агрегаты.

Соединение частиц в более крупные агрегаты называется коагуляцией, а осаждение их под влиянием силы тяжести - седиментацией.
Обычно коагуляция происходит при прибавлении к золю: 1) электролита, 2) другого золя, частицы которого имеют противоположный заряд, и 3) при нагревании
Слайд 15 Примером сложной дисперсионной системы является молоко, основные составные части которого – вода,

жир, козеин и молочный сахар.
Жир находится в виде эмульсии и при стоянии молока постепенно поднимается к верху (сливки).
Козеин (белок) содержится в виде раствора, похожего по свойствам на коллоидный, и самопроизвольно не выделяется, но легко может быть осажден (в виде творога) при подкислении молока, например, уксусом.
Слайд 16 В естественных условиях выделение козеина происходит при скисании молока. Молочный сахар находится

в виде молекулярного раствора и выделяется лишь при испарении воды.
Коллоидные растворы широко применяются в различных технологических процессах: мыловаренной, бумажной, текстильной промышленности и т.д.
Коллодиные растворы играют большую роль в жизнедеятельности организмов. Протоплазма живых клеток, кровь, сок растений – это коллоидные растворы (золи).














 Гальванические элементы
Гальванические элементы Строение атома углерода. 10 класс
Строение атома углерода. 10 класс Водородные соединения неметаллов
Водородные соединения неметаллов Водород. Свойства, применение
Водород. Свойства, применение Типы химических реакций. Решение примеров
Типы химических реакций. Решение примеров Определение формул органических веществ
Определение формул органических веществ Арены
Арены Фотохромные биоматериалы. Применение спиропирановых систем в медицине
Фотохромные биоматериалы. Применение спиропирановых систем в медицине Химические свойства кислорода. Применение кислорода
Химические свойства кислорода. Применение кислорода Кислоты в химии
Кислоты в химии Посвящение в химики
Посвящение в химики Звездный час. Конкурс химиков
Звездный час. Конкурс химиков Эксергетический баланс
Эксергетический баланс Соли. Химические свойства
Соли. Химические свойства Тосол. Гликолевые антифризы
Тосол. Гликолевые антифризы Оценка качества пищевой соли, реализуемой в розничной торговле
Оценка качества пищевой соли, реализуемой в розничной торговле Альдегиды
Альдегиды Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений Фтор. Биологическое значение, соединения и применение
Фтор. Биологическое значение, соединения и применение Природа и классификация химических связей
Природа и классификация химических связей Презентация по Химии "Химия в сельском хозяйстве"
Презентация по Химии "Химия в сельском хозяйстве"  Коллоидно-химическая теория схватывания и твердения вяжущих веществ
Коллоидно-химическая теория схватывания и твердения вяжущих веществ Основания как электролиты
Основания как электролиты Соли Na2SO4
Соли Na2SO4 Л-1 основные классы неорганических веществ
Л-1 основные классы неорганических веществ Физико-химические методы получения порошков металлов
Физико-химические методы получения порошков металлов Присоединение аммиака и аминов
Присоединение аммиака и аминов Насыщенные жирные кислоты
Насыщенные жирные кислоты