Содержание
- 2. Na2CO3 HCl NaCl + H2O +CO2
- 3. Роберт Бойль (1627-1691) «Масса вещества после реакции больше массы исходного металла.»
- 4. Михаил Васильевич Ломоносов (1711-1765) «Хотя между металлом и веществом, произошла химическая реакция, сумма масс исходных веществ
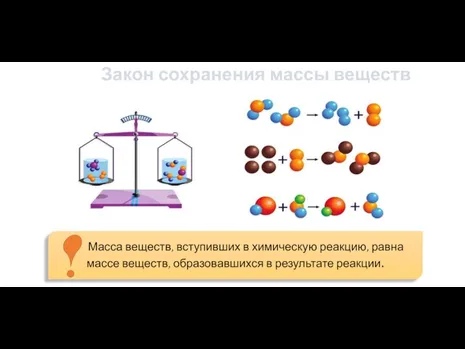
- 5. Закон сохранения массы веществ
- 6. При разложении нитрата меди (II) образовалось 1,6 г оксида меди(II), 1,84 г оксида азота (IV) и
- 7. H2 + O2 = H2O Mr (Исходных веществ) = Mr (Продуктов реакции) = Индекс (показывает число
- 8. 2H2 + O2 = 2H2O Исходные вещества Продукты реакции Коэффициент (показывает сколько данных молекул участвует или
- 9. Алгоритм составления уравнения химической реакции
- 11. Скачать презентацию







 Материаловедение и технология конструкционных материалов
Материаловедение и технология конструкционных материалов Температурная зависимость скорости химической реакции
Температурная зависимость скорости химической реакции Каучук. Строение и применение
Каучук. Строение и применение Классификация кислот
Классификация кислот Ионные уравнения реакций
Ионные уравнения реакций Коды Менделеева
Коды Менделеева Фенол. Физические свойства
Фенол. Физические свойства Тест 1 задание
Тест 1 задание Соли. Свойства. Получение
Соли. Свойства. Получение Презентация на тему Азотная кислота и её соли
Презентация на тему Азотная кислота и её соли  Применение серы
Применение серы рН розчину
рН розчину Тестирование по химии
Тестирование по химии Исследование интерактивной компьютерной химической модели
Исследование интерактивной компьютерной химической модели Вспомни… СаО, SО2, Fе2О3 , Nа2О, Сl2О7
Вспомни… СаО, SО2, Fе2О3 , Nа2О, Сl2О7 Аминокислоты. Викторина
Аминокислоты. Викторина Генетическая связь углеводородов, спиртов, альдегидов и карбоновых кислот
Генетическая связь углеводородов, спиртов, альдегидов и карбоновых кислот Презентация на тему Альдегиды и их свойства
Презентация на тему Альдегиды и их свойства  Карбоновые кислоты и их производные. (Лекция 11)
Карбоновые кислоты и их производные. (Лекция 11) Атом- сложная частица
Атом- сложная частица Аттестационная работа. Сколько наша семья потребляет энергоресурсов и выбрасывает углекислого газа
Аттестационная работа. Сколько наша семья потребляет энергоресурсов и выбрасывает углекислого газа Электролитическая диссоциация кислот
Электролитическая диссоциация кислот Нефть - природный источник углеводородов
Нефть - природный источник углеводородов Химия и автомобиль
Химия и автомобиль Строение атома углерода. 10 класс
Строение атома углерода. 10 класс Презентация на тему Основные понятия химии
Презентация на тему Основные понятия химии  Соль и ее свойства. Добыча соли
Соль и ее свойства. Добыча соли Гидролиз солей
Гидролиз солей