Содержание
- 2. Скорость химической реакции есть число элементарных актов химической реакции, происходящих в единицу времени в единице объема
- 3. Одной из задач, стоящих перед химической кинетикой, является определение состава реакционной смеси (т.е. концентраций всех реагентов)
- 4. Скорость химической реакции зависит от множества факторов: природы реагирующих веществ, концентрации, температуры, природы растворителя и т.д.
- 5. Закон действующих масс: Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях.
- 6. ХИМИЧЕСКАЯ КИНЕТИКА Коэффициент пропорциональности k есть константа скорости химической реакции. Физический смысл: Константа скорости численно равна
- 7. ХИМИЧЕСКАЯ КИНЕТИКА Зависимость скорости реакции от концентраций реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической
- 8. ХИМИЧЕСКАЯ КИНЕТИКА Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции есть
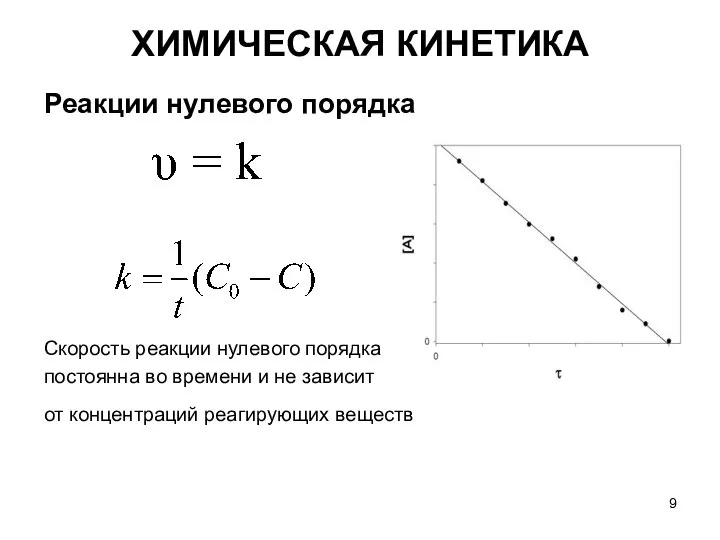
- 9. Реакции нулевого порядка Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих
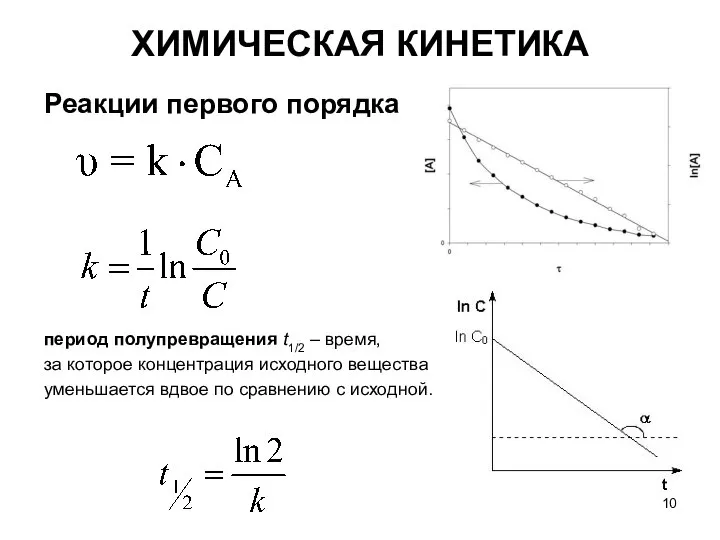
- 10. Реакции первого порядка период полупревращения t1/2 – время, за которое концентрация исходного вещества уменьшается вдвое по
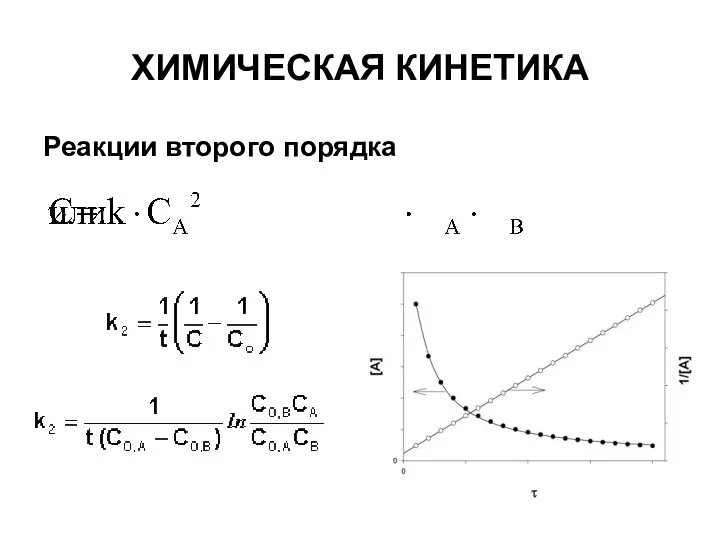
- 11. ХИМИЧЕСКАЯ КИНЕТИКА Реакции второго порядка
- 12. Молекулярность число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия. Различают:
- 13. Влияние температуры на скорость реакции Правило Вант-Гоффа При повышении температуры на каждые 10 градусов константа скорости
- 14. Теория активных столкновений (С. Аррениус) Условия для прохождения реакции: Молекулы должны столкнуться. Молекулы должны обладать необходимой
- 15. Уравнение Аррениуса столкновения молекул будут эффективны (т.е. будут приводить к реакции) только в том случае, если
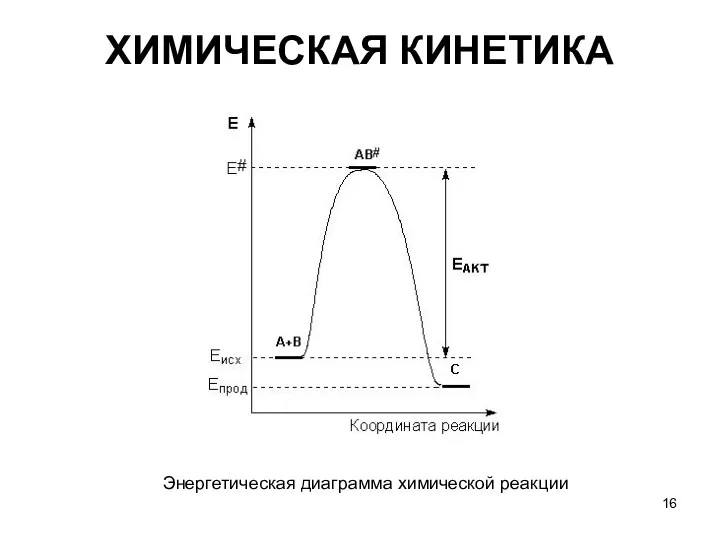
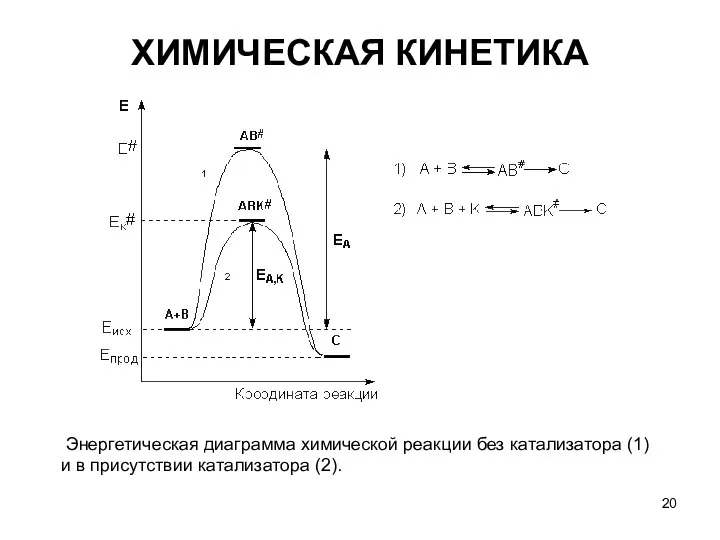
- 16. ХИМИЧЕСКАЯ КИНЕТИКА Энергетическая диаграмма химической реакции
- 17. ХИМИЧЕСКАЯ КИНЕТИКА Катализ – явление изменения скорости химической реакции в присутствии веществ, количество которых после реакции
- 18. ХИМИЧЕСКАЯ КИНЕТИКА Свойства катализаторов: Специфичность - способность ускорять только одну реакцию или группу однотипных реакций и
- 19. ХИМИЧЕСКАЯ КИНЕТИКА Причиной увеличения скорости реакции при положительном катализе является уменьшение энергии активации при протекании реакции
- 20. ХИМИЧЕСКАЯ КИНЕТИКА Энергетическая диаграмма химической реакции без катализатора (1) и в присутствии катализатора (2).
- 21. ХИМИЧЕСКАЯ КИНЕТИКА В зависимости от фазового состояния реагентов и катализатора различают: Гомогенный катализ каталитические реакции, в
- 22. ХИМИЧЕСКАЯ КИНЕТИКА Автокатализ процесс каталитического ускорения химической реакции одним из её продуктов. Особенность: реакция протекает с
- 23. ХИМИЧЕСКАЯ КИНЕТИКА Ферментативный катализ каталитические реакции, протекающие с участием ферментов – биологических катализаторов белковой природы. Особенности:
- 24. ХИМИЧЕСКОЕ РАВНОВЕСИЕ Обратимыми называют реакции, продукты которых могут между собой взаимодействовать с образованием исходных веществ. Состояние
- 25. ХИМИЧЕСКОЕ РАВНОВЕСИЕ принцип Ле-Шателье - Брауна, или принцип подвижного равновесия если на систему, находящуюся в равновесии,
- 26. ХИМИЧЕСКОЕ РАВНОВЕСИЕ Направление смещения равновесия в результате изменения температуры определяется знаком теплового эффекта реакции. Повышение температуры
- 27. ХИМИЧЕСКОЕ РАВНОВЕСИЕ Повышение давления смещает равновесие в сторону реакции, идущей с образованием меньшего количества молей газообразных
- 28. ХИМИЧЕСКОЕ РАВНОВЕСИЕ Увеличение концентрации одного из исходных веществ или уменьшение концентрации одного из продуктов реакции смещает
- 29. ХИМИЧЕСКОЕ РАВНОВЕСИЕ Катализаторы одинаково ускоряют, как прямую, так и обратную реакции и поэтому на смещение равновесия
- 31. Скачать презентацию























 Характеристика химических элементов IV А группа. Углерод
Характеристика химических элементов IV А группа. Углерод Использование инновационных технологий в обучении химии как средство повышения подготовки специалистов
Использование инновационных технологий в обучении химии как средство повышения подготовки специалистов Сталь 12Х18Н10Т
Сталь 12Х18Н10Т Презентация на тему Полисахариды
Презентация на тему Полисахариды  Минералы
Минералы Первоначальные химические понятия
Первоначальные химические понятия Свойства бензола
Свойства бензола Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов"
Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов"  Неорганические вещества
Неорганические вещества Карбоновые кислоты
Карбоновые кислоты Природный газ
Природный газ Фосфор
Фосфор Арены
Арены Первоначальные сведения о строении вещества
Первоначальные сведения о строении вещества Классы неорганических веществ. Оксиды
Классы неорганических веществ. Оксиды Массообменные процессы
Массообменные процессы Способы получения металлов
Способы получения металлов Правила ТБ при работе в кабинете химии. Приёмы обращения с лабораторным оборудованием
Правила ТБ при работе в кабинете химии. Приёмы обращения с лабораторным оборудованием Удивительная соль
Удивительная соль Полиморфизм кристаллов изатина
Полиморфизм кристаллов изатина Нуклеирующие добавки
Нуклеирующие добавки Презентация на тему Гигиенические аспекты загрязнения пищевых продуктов чужеродными веществами
Презентация на тему Гигиенические аспекты загрязнения пищевых продуктов чужеродными веществами  Эмульсии
Эмульсии Дифференцированный подход в преподавании химии
Дифференцированный подход в преподавании химии Аппаратурное оформление процесса гидроочистки нефтяных фракций
Аппаратурное оформление процесса гидроочистки нефтяных фракций Презентация на тему Жидкое состояние вещества
Презентация на тему Жидкое состояние вещества  Свинец (plumbum)
Свинец (plumbum) Презентация на тему Кремний и его соединения
Презентация на тему Кремний и его соединения