Содержание
- 3. Цель урока: 1.Сформировать понятие об окислительно-восстановительных реакциях. 2.Научиться уравнивать записи ОВР методом электронного баланса.
- 4. Вспомним … 1.Валентность. 2.Степень окисления. 3.Восстановитель. 4.Окислитель. 5.Типы химических реакций.
- 5. Значение окислительно - восстановительных процессов
- 11. Правила определения степеней окисления Следует запомнить: 1. Степени окисления атомов в простых веществах равны нулю: Na0;
- 12. 1. Степени окисления атомов в простых веществах равны нулю: Na0; H20 2. Алгебраическая сумма степеней окисления
- 13. Расчет степени окисления 1. Для веществ из двух элементов: -поставить постоянную степень окисления CO-2 -рассчитать степень
- 14. Расчет степени окисления 2.Для веществ из трех и более элементов: -поставить постоянные степени окисления H+1MnO4-2 -рассчитать
- 16. Зрительная гимнастика Тренажер Базарного В.Ф.
- 23. Будьте здоровы!
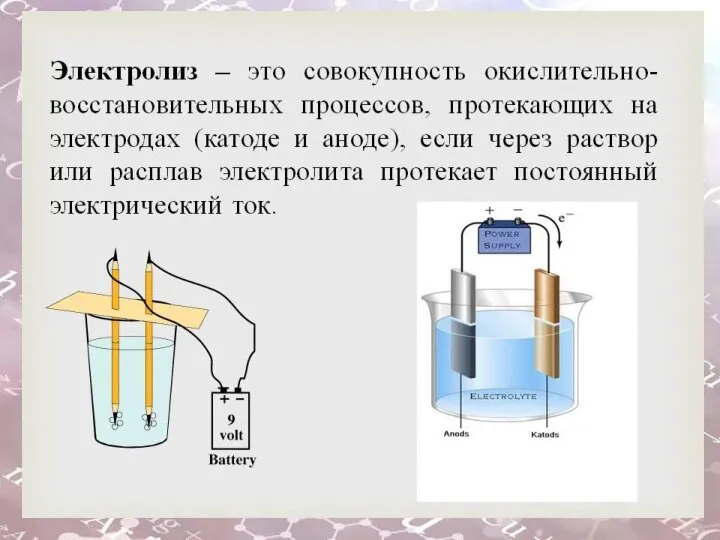
- 24. Электролиз
- 25. Цель: Сформировать представление учащихся об электролизе как совокупности окислительно- восстановительного процессов. . Задачи: 1. Что такое
- 26. Электролиз
- 27. При растворении электролитов в воде происходит электролитическая диссоциация. Носителями зарядов в водных растворах или расплавах электролитов
- 30. Исследовал электролиз и открыл его законы английский физик Майкл Фарадей в 1834 году Майкл Фарадей (1791
- 31. Второй закон электролиза При одинаковом количестве электричества (электрическом заряде, прошедшем через электролит) масса вещества, выделившегося при
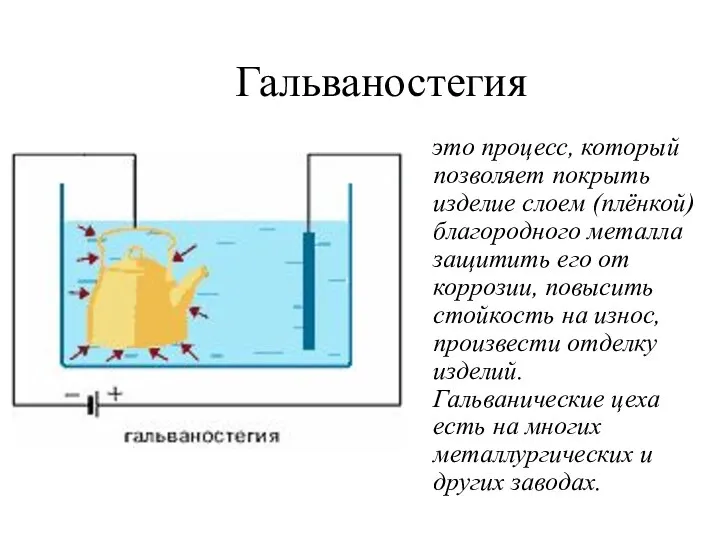
- 33. Гальваностегия это процесс, который позволяет покрыть изделие слоем (плёнкой) благородного металла защитить его от коррозии, повысить
- 34. Покрытие предметов слоем благородного металла
- 35. это получение электролитическим способом более толстых отложений (до нескольких миллиметров). ГАЛЬВАНОПЛАСТИКА Копия барельефа, полученная методом гальванопластики
- 36. Изготовление медалей, монет.
- 37. Домашнее задание
- 38. Добрый день, уважаемые студенты! Работы с домашним заданием по химии направлять до 14 ноября 2020г. на
- 39. Определите степени окисления атомов в соединениях: Na2S , P2O5 , MgS , CO2, FeO O2, Cl2
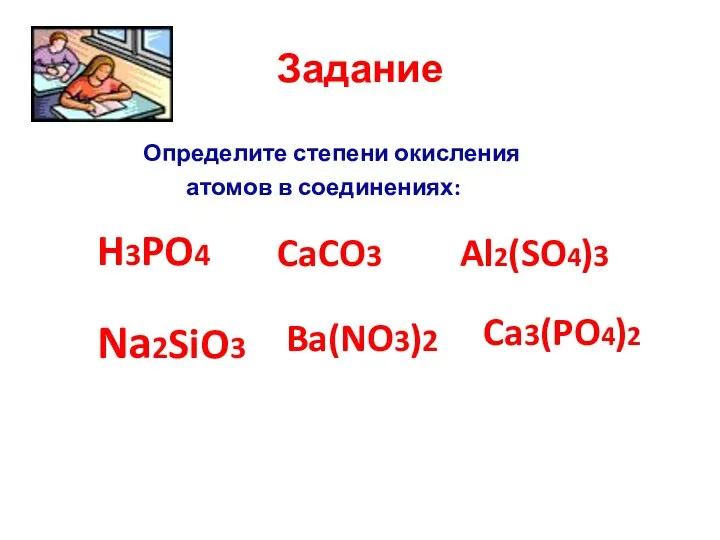
- 40. Задание Определите степени окисления атомов в соединениях: H3PO4 CaCO3 Al2(SO4)3 Na2SiO3 Ba(NO3)2 Ca3(PO4)2
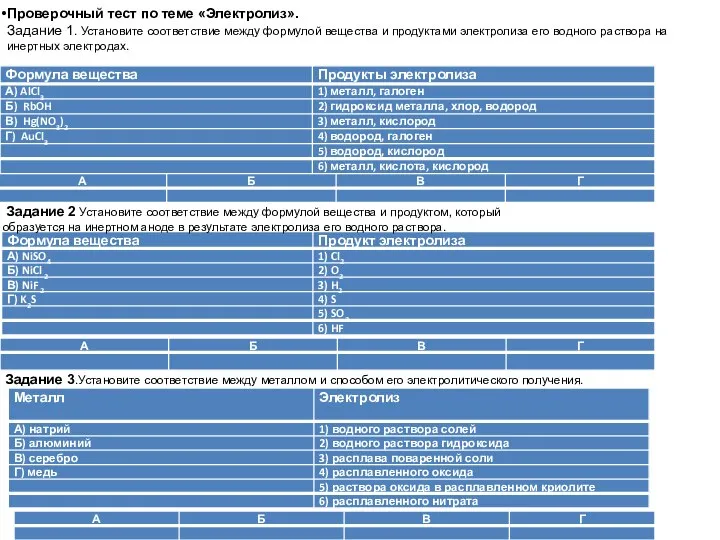
- 41. Проверочный тест по теме «Электролиз». Задание 1. Установите соответствие между формулой вещества и продуктами электролиза его
- 42. СПАСИБО ЗА ВНИМАНИЕ!
- 44. Скачать презентацию
































 Свойства солей, оксидов, оснований
Свойства солей, оксидов, оснований Расчетная ячейка при МД моделировании. Граничные условия. Элементарная ячейка для атомов аргона
Расчетная ячейка при МД моделировании. Граничные условия. Элементарная ячейка для атомов аргона Карбоновые кислоты. Сложные эфиры. Жиры
Карбоновые кислоты. Сложные эфиры. Жиры Аномальные свойства воды
Аномальные свойства воды Кислоты основания и соли как электролиты
Кислоты основания и соли как электролиты Органическая химия. Теория строения органических веществ
Органическая химия. Теория строения органических веществ Альдегиды. Кетоны
Альдегиды. Кетоны Алкадиены. Физические свойства
Алкадиены. Физические свойства Эвапориты. Химические осадки из ионных растворов
Эвапориты. Химические осадки из ионных растворов Электролитическая диссоциация
Электролитическая диссоциация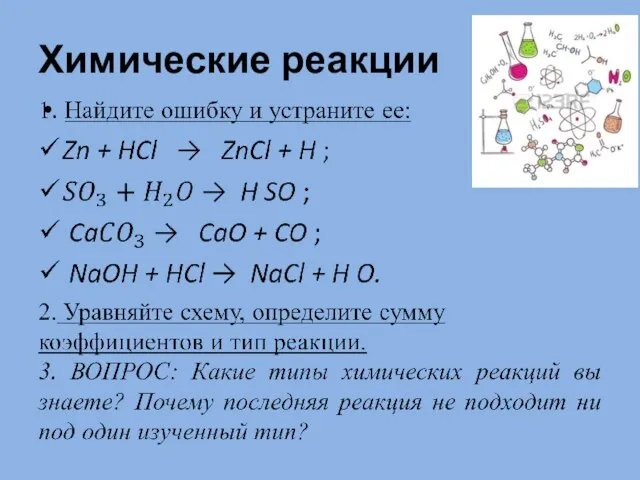 Химические реакции
Химические реакции Алкины
Алкины Бутан как хладагент
Бутан как хладагент Буферные системы
Буферные системы Определение плотности газообразного вещества по плотности
Определение плотности газообразного вещества по плотности Гидроксиды металлов
Гидроксиды металлов Химия. 8 класс
Химия. 8 класс Конкурс проектных работ Химический элемент … – и это все о нем
Конкурс проектных работ Химический элемент … – и это все о нем Определение площади поверхности и пористости материалов методом сорбции газов
Определение площади поверхности и пористости материалов методом сорбции газов Тема урока: «Свойства тканей из химических волокон»
Тема урока: «Свойства тканей из химических волокон» a319f492a6071afff03d7efc722c906b
a319f492a6071afff03d7efc722c906b Органическая химия как наука. Основные положения теории строения химических соединений. Структурная изомерия
Органическая химия как наука. Основные положения теории строения химических соединений. Структурная изомерия Вещества простые и сложные
Вещества простые и сложные Состав атома
Состав атома Цинк (Zn)
Цинк (Zn) Азот и его соединения
Азот и его соединения Графит (С)
Графит (С) Карбоновые кислоты. Д.И. Менделеев
Карбоновые кислоты. Д.И. Менделеев