Слайд 2Задание 4. Валентность. Степень окисления химических элементов.
Примерное время выполнения задания – 5

минут
Уровень сложности задания – повышенный
Максимальный балл за выполнение задания - 2
Задание № 4 направлено на проверку знания важнейших химических понятий «электроотрицательность», «валентность» и «степень окисления», а также умения определять степень окисления и валентность элементов в соединениях.
Задание содержит в одном столбце формулы (названия) веществ, во втором – степени окисления или валентность химических элементов. К каждой позиции, обозначенной буквой, необходимо подобрать соответствующую позицию, обозначенную цифрой. В ответе нужно записать получившуюся последовательность цифр. Цифры могут повторяться.
Слайд 3Перед выполнением предложенных заданий повторите:
Степень окисления – это условная величина, численно равная

количеству электронов, которое отдает атом, приобретающий положительный заряд, или количеству электронов, которое присоединяет к себе атом, приобретающий отрицательный заряд.
Степень окисления обозначается арабскими цифрами, может быть отрицательной или положительной.
Слайд 4Правила расчета степени окисления
Степень окисления элементов в простых веществах всегда равна 0.
Сумма

всех степеней окисления в молекуле равна 0, а в ионе – заряду иона.
Фтор (как самый электроотрицательный элемент) всегда проявляет степень окисления -1.
Кислород почти всегда проявляет степень окисления -2, кроме соединений с фтором, например O2+1F2, O+2F2, а также пероксидов Н2О2-1 и супероксидов КО2-1/2.
Металлы проявляют положительные степени окисления. Металлы IА группы имеют постоянную степень окисления +1, металлы IIА группы - +2, металлы IIIА группы - +3. У металлов побочных подгрупп нет постоянной степени окисления.
Слайд 5Правила расчета степени окисления
Степени окисления неметаллов зависят от того, с какими атомами

они соединены:
если только с атомом металла, то степень окисления неметалла отрицательная (например, сульфиды металлов: Na2+1S-2);
если с атомом неметалла, то степень окисления может быть и положительная, и отрицательная – это зависит от электроотрицательности атомов элементов, входящих в соединение. Например, в сероводороде H2+1S-2 сера более электроотрицательна по сравнению с водородом, а в соединении с кислородом S+2O3-2 менее электроотрицательна.
Водород чаще всего проявляет степень окисления +1, кроме гидридов металлов, где степень окисления равна -1, например, Na+1H-1.
Максимальна степень окисления для неметаллов IА – VIIIА подгрупп (кроме кислорода и фтора) равна номеру группы, минимальная степень окисления для этих элементов рассчитывается по формуле: номер группы минус 8.
Для металлов минимальная степень окисления – 0.
Слайд 6Валентность - свойства атомов данного элемента присоединять или замещать в соединениях определённое
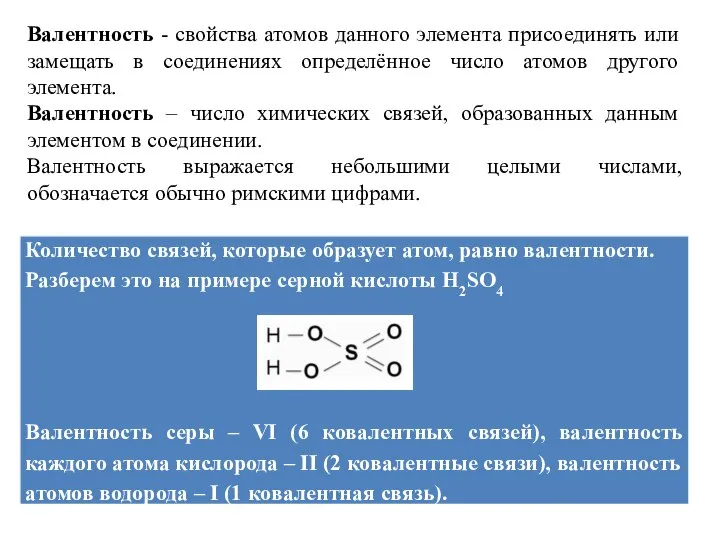
число атомов другого элемента.
Валентность – число химических связей, образованных данным элементом в соединении.
Валентность выражается небольшими целыми числами, обозначается обычно римскими цифрами.
Слайд 7
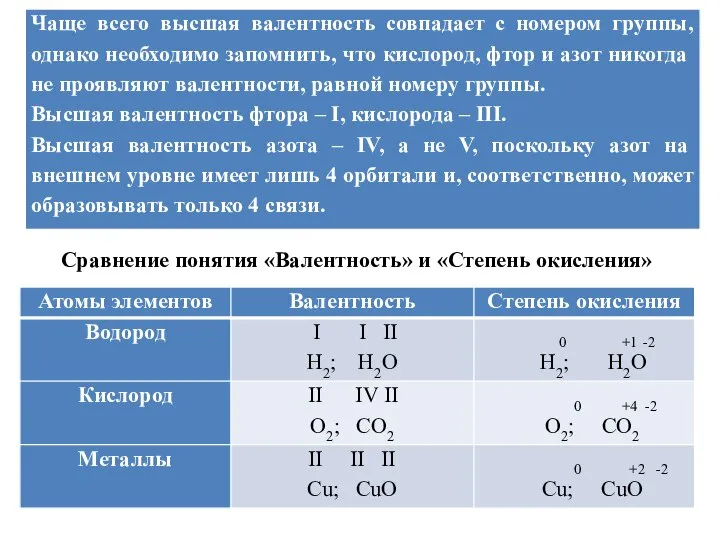
Сравнение понятия «Валентность» и «Степень окисления»







 Презентация на тему Электрохимический ряд напряжений металлов
Презентация на тему Электрохимический ряд напряжений металлов  Дисперсные системы с твёрдой средой и газообразной фазой
Дисперсные системы с твёрдой средой и газообразной фазой _Периодический закон. Распределение электронов по энергетическим уровням и подуровням (1)
_Периодический закон. Распределение электронов по энергетическим уровням и подуровням (1) Молярный объем
Молярный объем Щелочные металлы — это элементы главной подгруппы I группы
Щелочные металлы — это элементы главной подгруппы I группы Металлом называется светлое тело, которое ковать можно
Металлом называется светлое тело, которое ковать можно Презентация на тему Нанохимия
Презентация на тему Нанохимия  Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук.
Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук. Современная аналитическая химия.Учебная литература
Современная аналитическая химия.Учебная литература Урок № 4
Урок № 4 Фторопласты и их использование
Фторопласты и их использование Свойства солей, оксидов, оснований
Свойства солей, оксидов, оснований Криогенный разрыв пласта
Криогенный разрыв пласта Астат. Свойства астата
Астат. Свойства астата Презентация на тему Сведения о воде
Презентация на тему Сведения о воде  Стероиды. Дицетин-холестерин-ацилтрансферазная реакция
Стероиды. Дицетин-холестерин-ацилтрансферазная реакция Направление процесса. ОВР
Направление процесса. ОВР Гликолиз. Глюконеогенез. Пентозофосфатный путь
Гликолиз. Глюконеогенез. Пентозофосфатный путь Применение центрифугирования
Применение центрифугирования Основания. 8 класс
Основания. 8 класс Презентация по Химии "Строение и физические свойства металлов"
Презентация по Химии "Строение и физические свойства металлов"  Химические свойства металлов. Электрохимический ряд напряжения металлов
Химические свойства металлов. Электрохимический ряд напряжения металлов Звездный час. Конкурс химиков
Звездный час. Конкурс химиков Bool-doser team
Bool-doser team Вещество. Свойства вещества. Урок №2
Вещество. Свойства вещества. Урок №2 Титриметрический анализ
Титриметрический анализ Проточные реакторы непрерывного действия. (Лекция 5)
Проточные реакторы непрерывного действия. (Лекция 5) Химический анализ
Химический анализ