Содержание
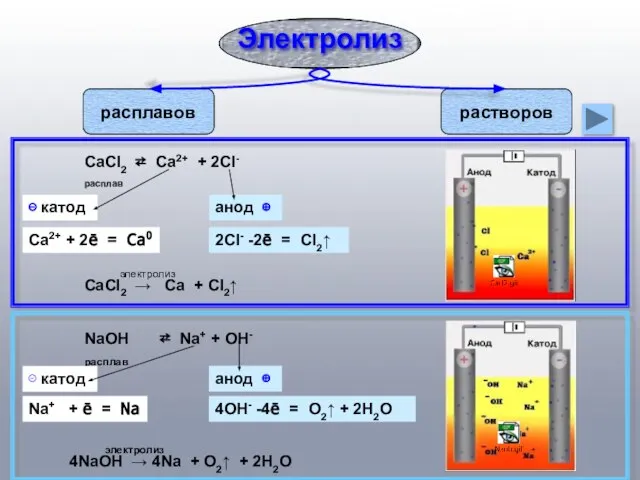
- 2. Электролиз расплавов растворов CaCl2 ⇄ Ca2+ + 2Cl- расплав ⊝ катод анод ⊕ Ca2+ + 2ē
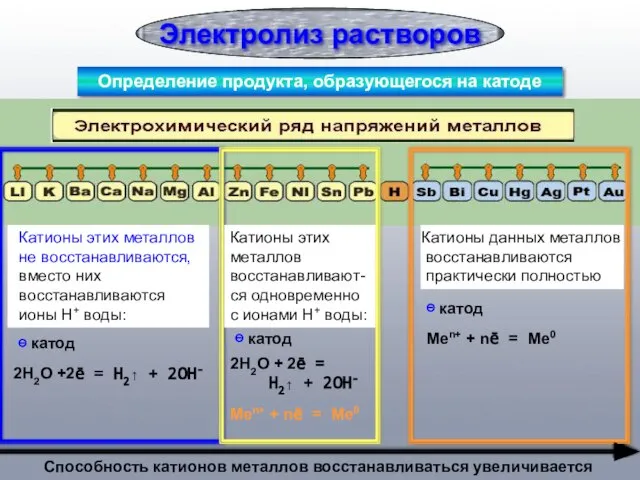
- 3. Электролиз растворов Определение продукта, образующегося на катоде Катионы этих металлов не восстанавливаются, вместо них восстанавливаются ионы
- 4. Электролиз растворов Определение продукта, образующегося на аноде S2- I- Br- Cl- OH- SO42- NO3- CO32- PO43-
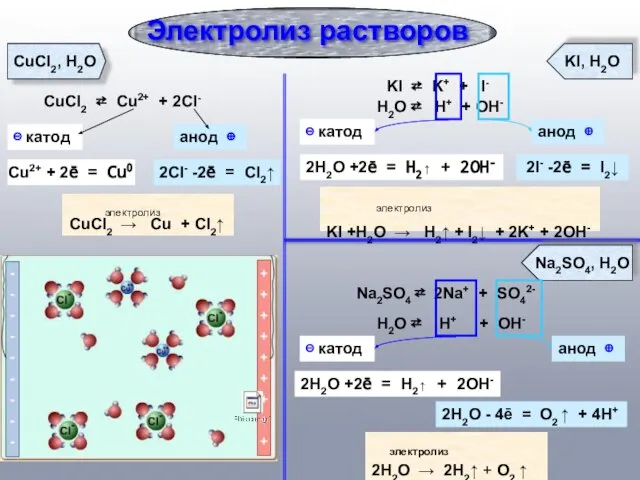
- 5. CuCl2 ⇄ Cu2+ + 2Cl- Электролиз растворов ⊝ катод анод ⊕ Cu2+ + 2ē = Cu0
- 6. Na2SO4 + H2O → Диссоциация: Na2SO4 →2 Na+ + SO42− аноде (+) : SO42−, Н2О: 2
- 7. Ni2+ + 2e− = Ni0 2Н2О + 2e− = Н20 + 2ОН−; NiSO4 + H2O →
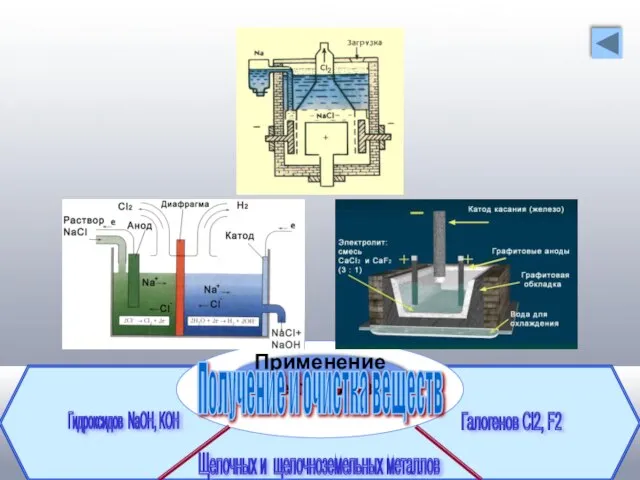
- 8. Применение электролиза Получение и очистка веществ Щелочных и щелочноземельных металлов Гидроксидов NaOH, KOH Галогенов Cl2, F2
- 10. Скачать презентацию



 Сероводород и сульфиды
Сероводород и сульфиды Щелочноземельные металлы
Щелочноземельные металлы ліпіди
ліпіди Составитель: Денисова В.Г.
Составитель: Денисова В.Г. Изучение возможности синтеза порошка сложного карбонитрида -титана молибдена Ti-Mo в режиме СВС
Изучение возможности синтеза порошка сложного карбонитрида -титана молибдена Ti-Mo в режиме СВС Соединения железа в природе
Соединения железа в природе Коррозия металлов
Коррозия металлов Роль железа в жизни общества и в здоровье человека
Роль железа в жизни общества и в здоровье человека Липиды
Липиды Понятие об адсорбционной влаге
Понятие об адсорбционной влаге Презентация на тему Неорганические полимеры
Презентация на тему Неорганические полимеры  Кислоты. Состав, названия и классификация
Кислоты. Состав, названия и классификация Природные источники углеводородов. Природный и попутный нефтяные газы. Нефть. Каменный уголь
Природные источники углеводородов. Природный и попутный нефтяные газы. Нефть. Каменный уголь Несовершенства и дефекты кристаллической решетки полимеров
Несовершенства и дефекты кристаллической решетки полимеров Химический опыт Черный сахар
Химический опыт Черный сахар Теория химического строения органических веществ А.М. Бутлерова
Теория химического строения органических веществ А.М. Бутлерова Гидролиз солей
Гидролиз солей Антидетонационные добавки на основе синергетических смесей оксигенатов к бензиновым топливам
Антидетонационные добавки на основе синергетических смесей оксигенатов к бензиновым топливам Сахароза
Сахароза ОГЭ химия. Основной государственный экзамен
ОГЭ химия. Основной государственный экзамен Получение формальдегида методом дегидрирования метанола
Получение формальдегида методом дегидрирования метанола Железо как химический элемент
Железо как химический элемент Общая характеристика элементов IIА группы
Общая характеристика элементов IIА группы Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов Сильные и слабые кислоты и основания
Сильные и слабые кислоты и основания Презентация на тему Таблица Менделеева внутри нас
Презентация на тему Таблица Менделеева внутри нас  Атом. Изотопы
Атом. Изотопы Качественные реакции в химии
Качественные реакции в химии