Содержание
- 2. Цель: - Проследить связь физики с химией при изучении химического элемента - углерода - Изучить аллотропные
- 3. Воспитательные задачи: Продолжить развивать интерес к научным знаниям, активизировать познавательную деятельность. Продолжить формировать умение выделять главное,
- 4. Обеспечение занятия Периодическая система элементов; Модели кристаллических решеток графита, алмаза, образцы карельского шунгита; Плакаты по строению
- 5. Содержание Элемент углерод в Периодической системе элементов Аллотропные модификации углерода, их свойства и значимость Карельский шунгит
- 6. Углерод С - Сarboneum от латинского слова carbo – уголь неметаллический химический элемент находится во 2
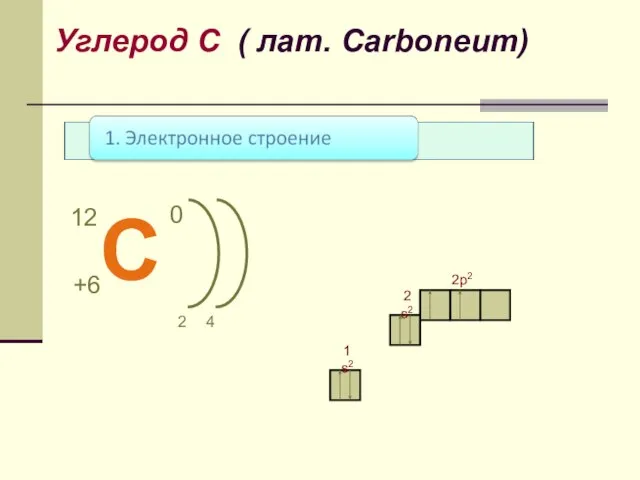
- 7. 1 s2 2 s2 2p2 Углерод С ( лат. Сarboneum)
- 8. Углерод в природе Встречается в свободном состоянии в виде алмаза, графита, аморфного углерода, карбина, фуллерена, обнаруженного
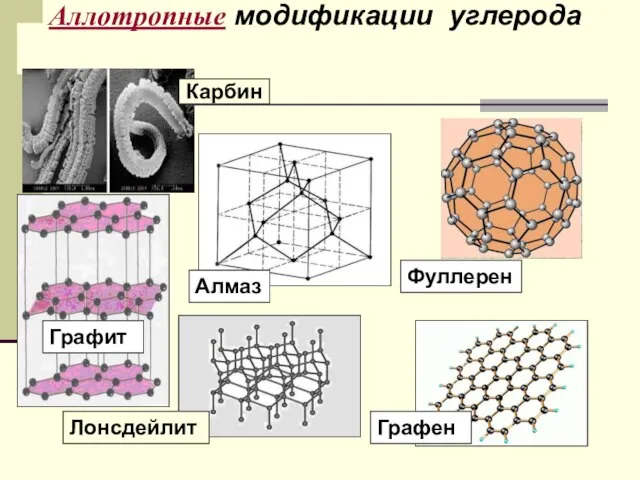
- 9. Аллотропия- существование химических элементов в виде двух и более веществ. Для углерода: Графит, алмаз, фуллерен, карбин,
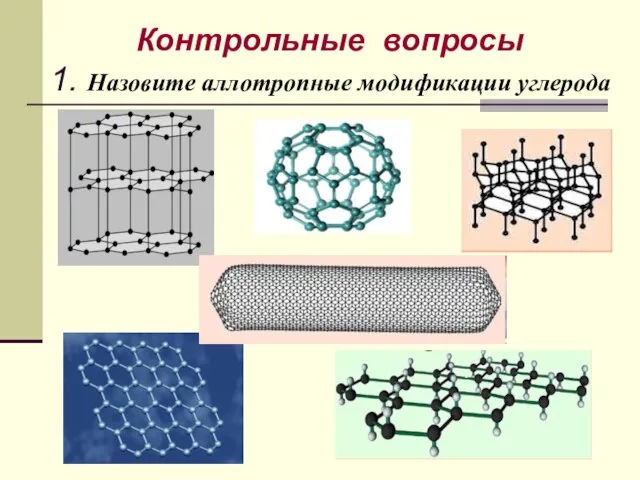
- 10. Аллотропные модификации углерода Алмаз Графит Лонсдейлит Графен Фуллерен Карбин
- 11. Карбин мелкокристаллический порошок чёрного цвета, обладает полупроводниковыми свойствами. Получен в искусственных условиях из длинных параллельных цепочек
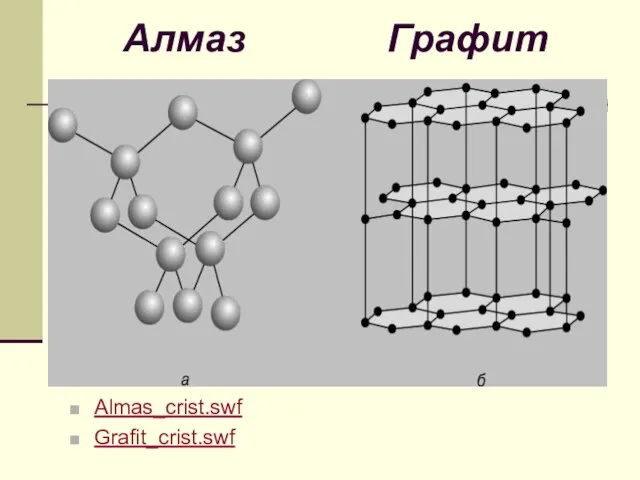
- 12. Алмаз Графит Almas_crist.swf Grafit_crist.swf
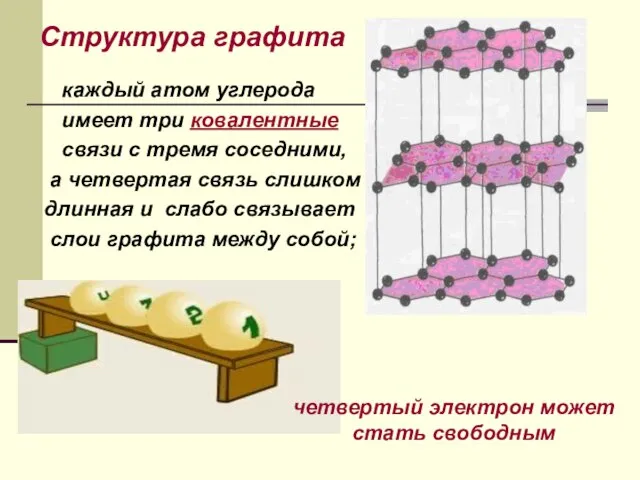
- 13. Структура графита каждый атом углерода имеет три ковалентные связи с тремя соседними, а четвертая связь слишком
- 14. Физические свойства графита – мягкое черное вещество из легко слоящихся кристалликов, - проводит электрический ток, -
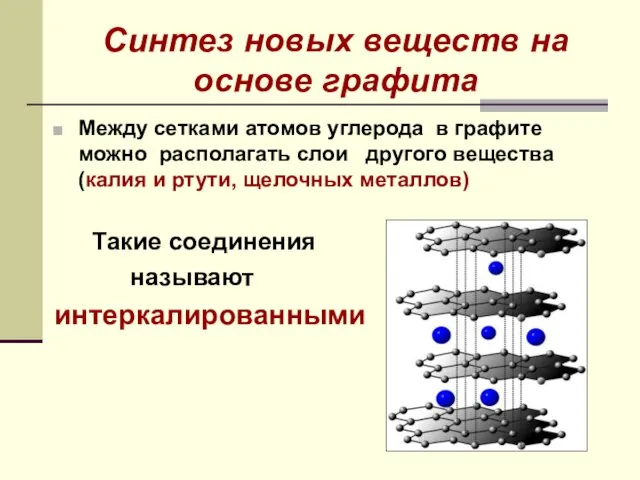
- 15. Синтез новых веществ на основе графита Между сетками атомов углерода в графите можно располагать слои другого
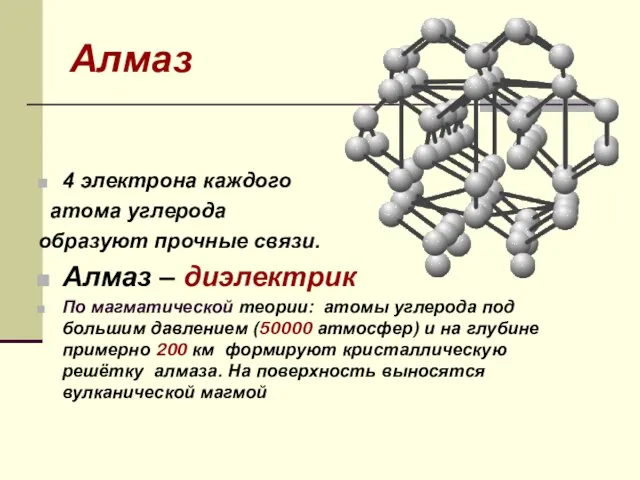
- 16. Алмаз 4 электрона каждого атома углерода образуют прочные связи. Алмаз – диэлектрик По магматической теории: атомы
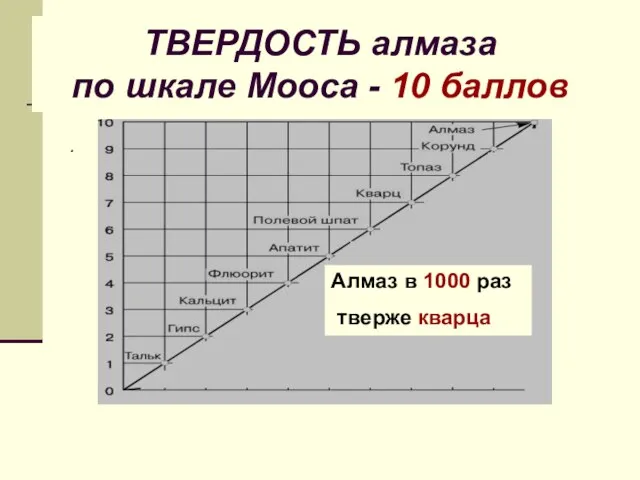
- 17. ТВЕРДОСТЬ алмаза по шкале Мооса - 10 баллов . Алмаз в 1000 раз тверже кварца
- 18. Перспективно развитие микроэлектронных устройств на основе алмаза. Алмаз используют для изготовления ножей, свёрл для обработки металлов
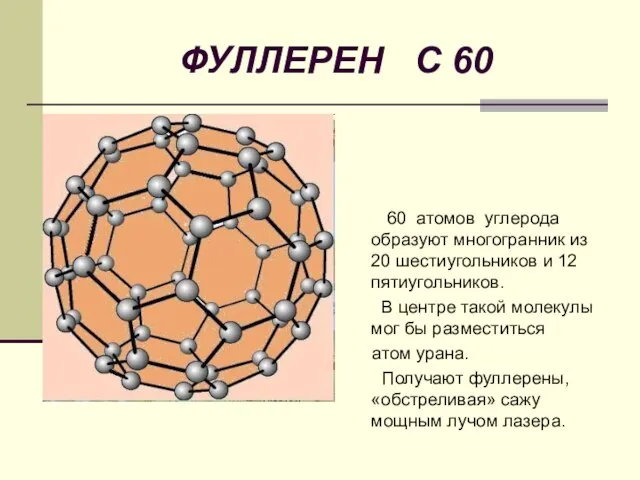
- 19. ФУЛЛЕРЕН С 60 60 атомов углерода образуют многогранник из 20 шестиугольников и 12 пятиугольников. В центре
- 20. История открытия фуллеренов В 1985 году впервые обнаружена молекула фуллерена после лазерного облучения графита В 1992
- 21. Более трети элементов периодической таблицы могут быть помещены внутрь молекулы фуллерена С60 Здание Биосферы в Монреале
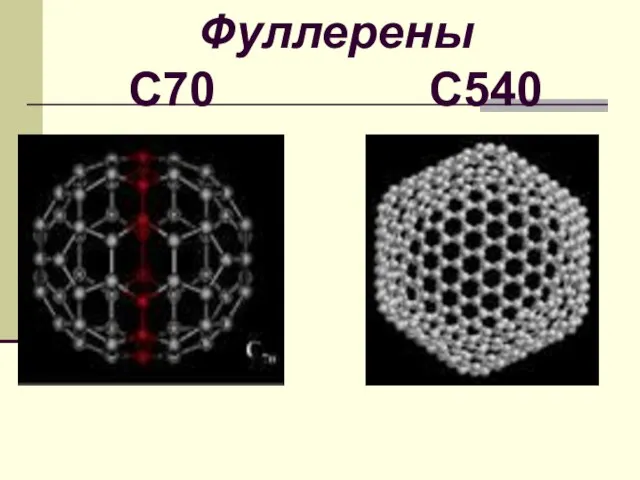
- 22. Фуллерены С70 С540
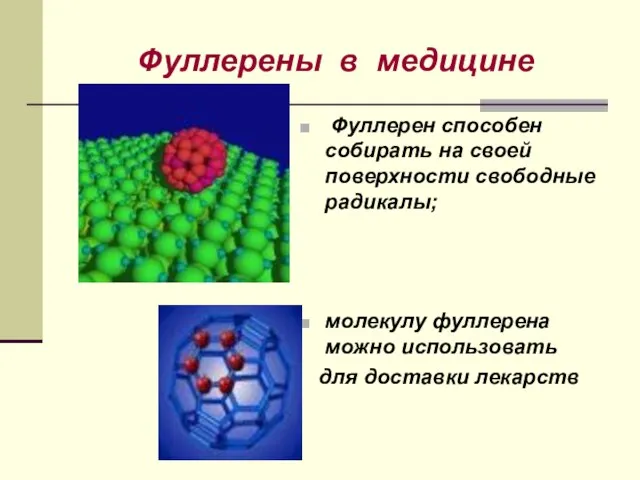
- 23. Фуллерены в медицине Фуллерен способен собирать на своей поверхности свободные радикалы; молекулу фуллерена можно использовать для
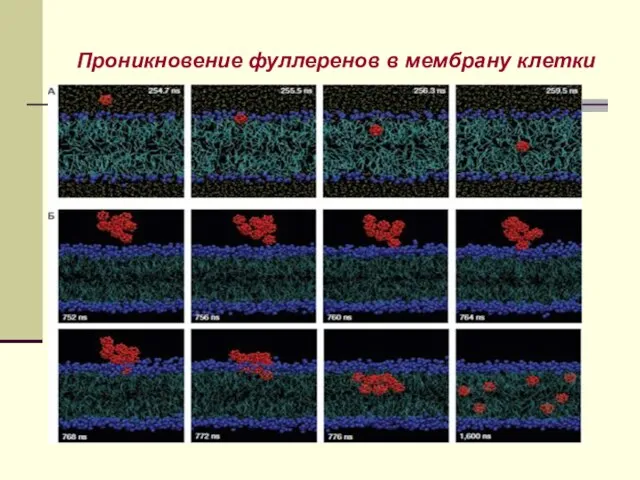
- 24. Проникновение фуллеренов в мембрану клетки
- 25. Органическая наноэлектроника на основе фуллерена С60 сконструированы полупроводниковые гибкие устройства их можно изгибать без нарушения их
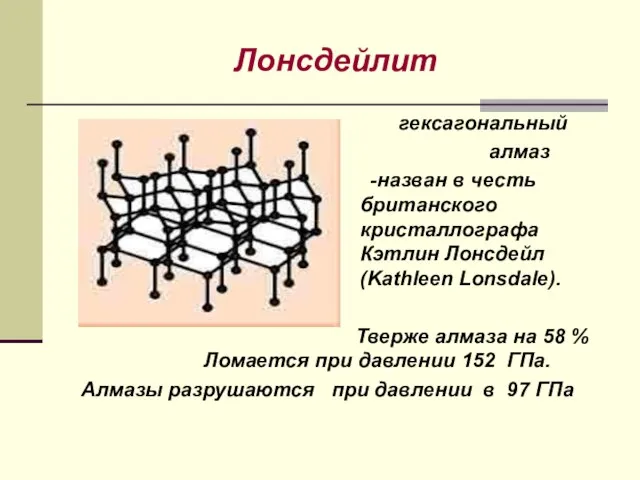
- 26. Лонсдейлит гексагональный алмаз -назван в честь британского кристаллографа Кэтлин Лонсдейл (Kathleen Lonsdale). Тверже алмаза на 58
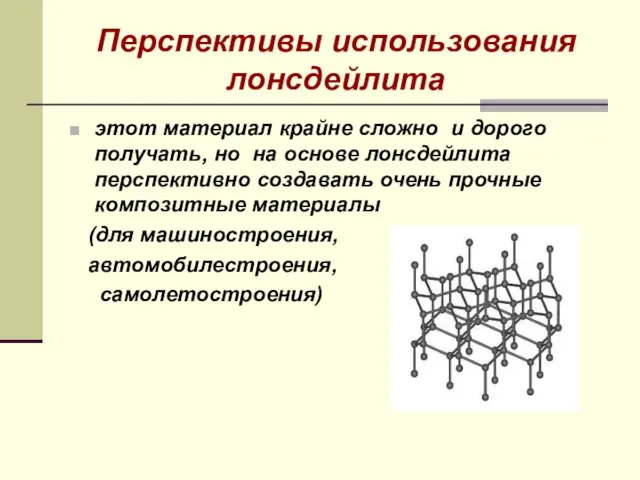
- 27. Перспективы использования лонсдейлита этот материал крайне сложно и дорого получать, но на основе лонсдейлита перспективно создавать
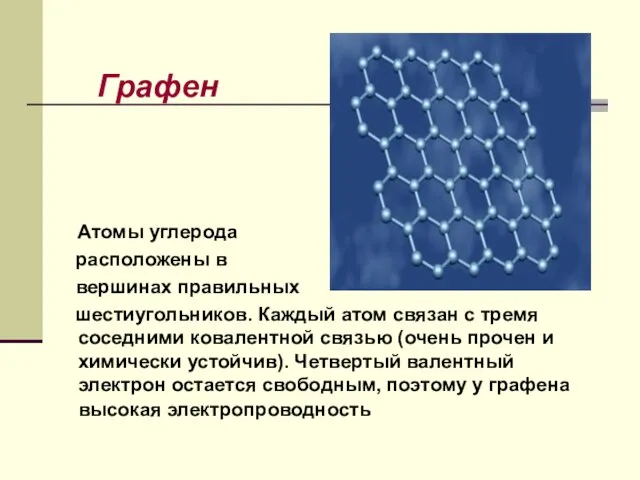
- 28. Графен Атомы углерода расположены в вершинах правильных шестиугольников. Каждый атом связан с тремя соседними ковалентной связью
- 29. Графен Нобелевская премия по физике в 2010 году присуждена Новоселову К. и Гейму А. «За новаторские
- 30. Дефекты Идеальный графен состоит из шестиугольных ячеек. Наличие пятиугольных ячеек приводит к сворачиванию атомной плоскости в
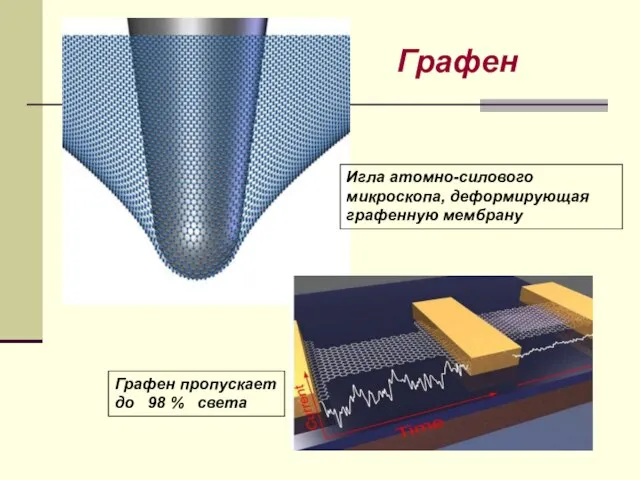
- 31. Игла атомно-силового микроскопа, деформирующая графенную мембрану Графен пропускает до 98 % света Графен
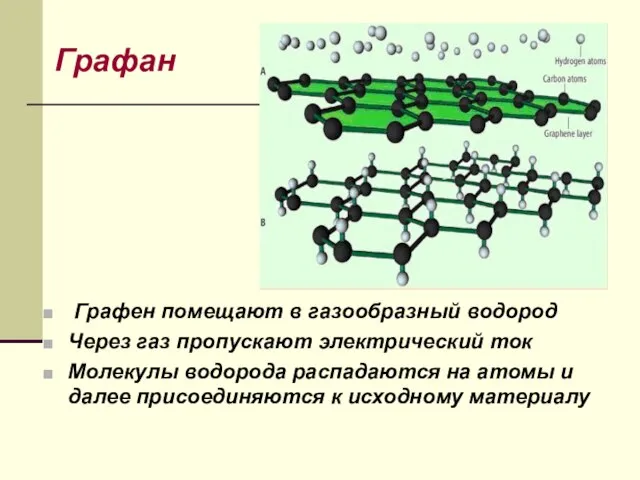
- 32. Графан Графен помещают в газообразный водород Через газ пропускают электрический ток Молекулы водорода распадаются на атомы
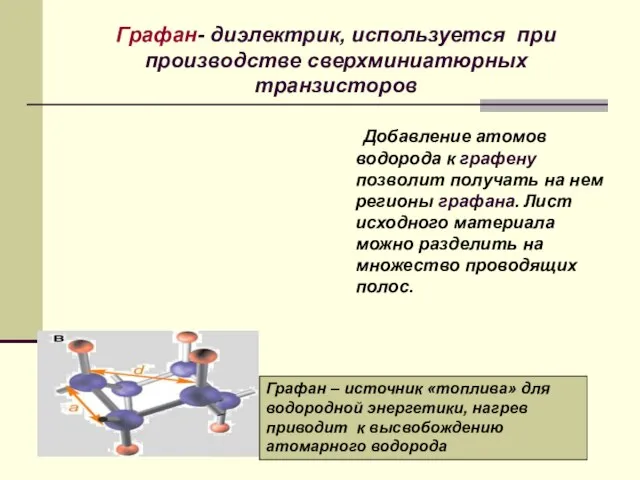
- 33. Графан- диэлектрик, используется при производстве сверхминиатюрных транзисторов Добавление атомов водорода к графену позволит получать на нем
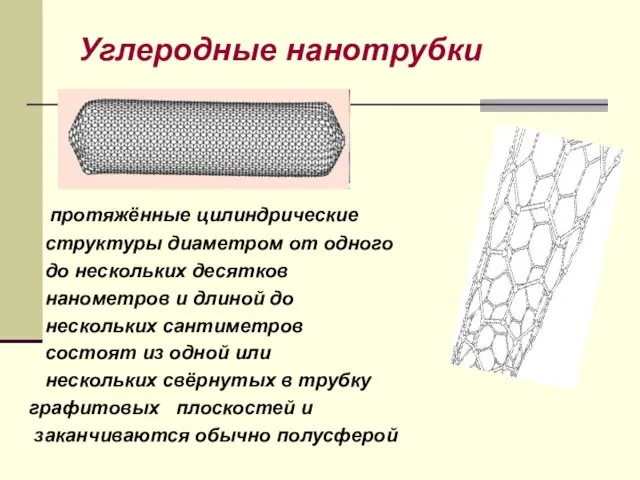
- 34. Углеродные нанотрубки протяжённые цилиндрические структуры диаметром от одного до нескольких десятков нанометров и длиной до нескольких
- 35. История открытия нанотрубок - нельзя назвать точную дату их открытия. - В 1991 году японский профессор
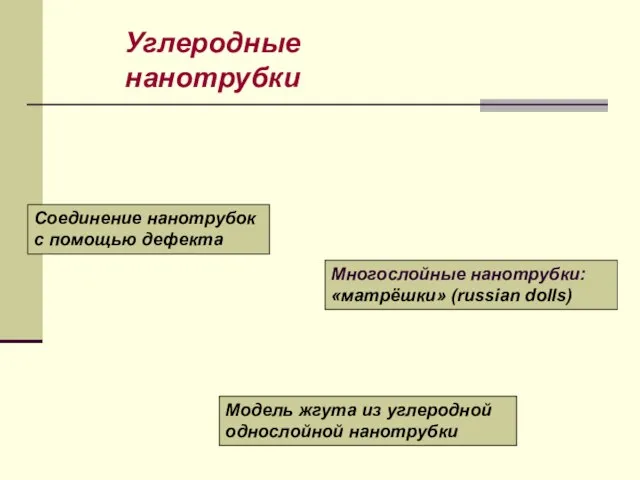
- 36. Углеродные нанотрубки Соединение нанотрубок с помощью дефекта Модель жгута из углеродной однослойной нанотрубки Многослойные нанотрубки: «матрёшки»
- 37. «Эффект домино»: Под действием сжатия происходит коллапс углеродной одностенной нанотрубки Можно использовать в качестве ускорителя молекул,
- 38. Многослойные углеродные нанотрубки - «наноперина» получают из ксилола при сжатии при 800 ° C при помощи
- 39. Нанопена мельчайшая сетка из углеродных нанотрубок получена при облучении углеродной мишени мощным лазером при температуре 10
- 40. Применение нанопены в медицине введение микроскопических количеств нанопены в кровоток позволяет отслеживать течение крови в капиллярах
- 41. Шунгит или, как его называли раньше, «Олонецкий чернозем» (найден в Олонецкой губернии). Свое более позднее название
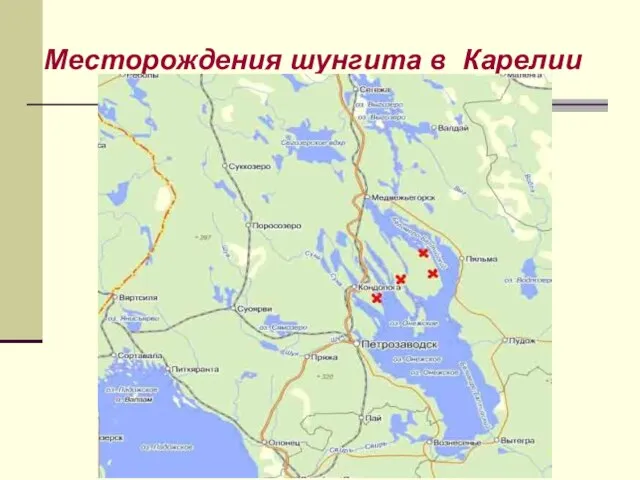
- 42. Месторождения шунгита в Карелии
- 43. Углерод - особый химический элемент Д.И.Менделеев в « Основах химии» писал: «Способность атомов углерода соединяться между
- 44. Соединения углерода Углерод может соединяться не только с водородом Н, но и с другими элементами, в
- 45. Органическая химия Органической химией изначально называлась химия веществ, полученных из организмов растений и животных Понятие «органическая
- 46. Теория строения органических веществ Величайшим обобщением знаний о неорганических веществах является Периодический закон и Периодическая система
- 47. Бутлеров Александр Михайлович / 1828 - 1886 / Русский химик, академик Петербурской А Н Создатель теории
- 48. Классификация органических веществ Углеводороды Предельные углеводороды (алканы) Непредельные углеводороды Алкены Алкины Алкадиены (диеновые углеводороды) Циклические углеводороды
- 49. Значение органической химии Без знаний органической химии невозможно понять, как осуществляется функционирование систем живого организма, т.
- 50. Контрольные вопросы 1. Назовите аллотропные модификации углерода
- 51. Контрольные вопросы 2. Какая из аллотропных модификаций углерода обладает наибольшей твердостью? Алмаз Графит Лонсдейлит Фуллерен 3.
- 52. Контрольные вопросы 4. Кто создал теорию химического строения органических веществ? Менделеев Резерфорд Бутлеров Берцелиус 5. Появление
- 53. Контрольные вопросы 6. Какая аллотропная модификация углерода является проводником электрического тока? Алмаз Графан Графит 7. Какая
- 54. Контрольные вопросы 8. Почему органическую химию назвали химией углерода? Атомы углерода могут соединяться друг с другом;
- 55. Вывод: При таком многообразии аллотропных модификаций углерода перспективы для создания новых современных материалов с заранее заданными
- 56. Домашнее задание Проанализируйте физические свойства аллотропных модификаций углерода Подготовьте сообщение о перспективах использования аллотропных модификаций углерода
- 57. Углерод и его аллотропные модификации. Органическая химия – химия углерода Углерод и его аллотропные модификации. Органическая
- 60. Скачать презентацию



































 Гигиена воздуха
Гигиена воздуха 1
1 Суд над химическим элементом Углерод
Суд над химическим элементом Углерод Учитель химии МАОУ СОШ № 61 города Тюмени Белова Н.В.
Учитель химии МАОУ СОШ № 61 города Тюмени Белова Н.В. Жиры
Жиры Капроновая (гексановая) кислота
Капроновая (гексановая) кислота Гидролиз солей
Гидролиз солей Самородные металлы
Самородные металлы В мире индикаторов
В мире индикаторов Нуклеиновые кислоты (НК)
Нуклеиновые кислоты (НК) Теория строения химических соединений
Теория строения химических соединений Природные и искусственные материалы. Естествознание 6 класс
Природные и искусственные материалы. Естествознание 6 класс Реакционная способность углеводородов. Реакции SR, АЕ , SЕ
Реакционная способность углеводородов. Реакции SR, АЕ , SЕ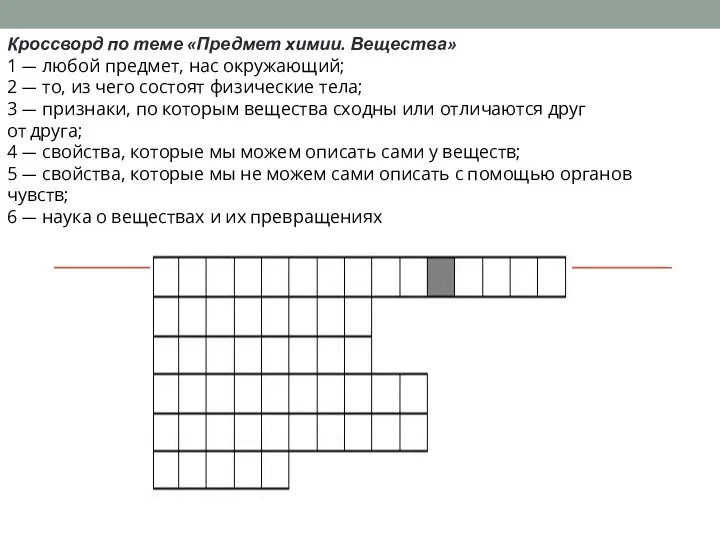 Предмет химии. Вещества
Предмет химии. Вещества Карбид кальция. Назначение
Карбид кальция. Назначение Основания и их свойства
Основания и их свойства Закономерности изменения свойств галогенов
Закономерности изменения свойств галогенов Окислительно-восстановительные реакции (часть 2)
Окислительно-восстановительные реакции (часть 2)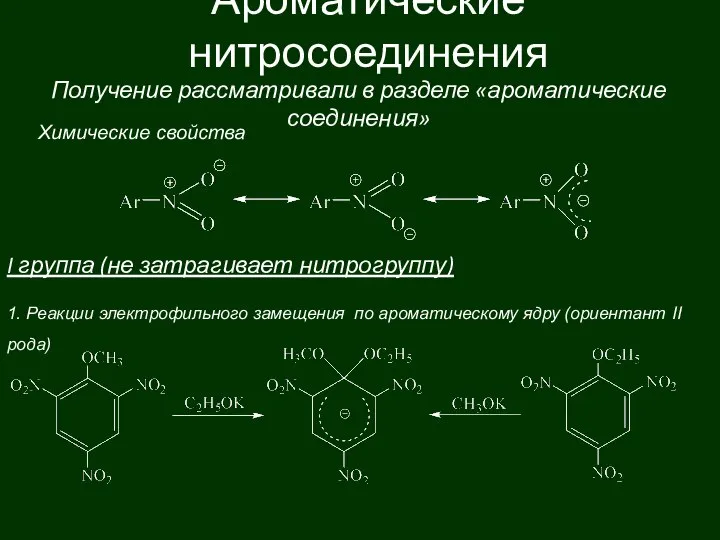 Ароматические нитросоединения
Ароматические нитросоединения строение атома
строение атома Окислительно-восстановительные реакции. Лекция №7
Окислительно-восстановительные реакции. Лекция №7 Анилин (амидобензол, аминобензол, фениламин)
Анилин (амидобензол, аминобензол, фениламин) Генетическая связь между классами органических веществ
Генетическая связь между классами органических веществ Канифоль. Физико-химические показатели
Канифоль. Физико-химические показатели Техника титрования и лабораторная посуда
Техника титрования и лабораторная посуда Подготовка проб товаров к анализу. Химико-аналитический контроль
Подготовка проб товаров к анализу. Химико-аналитический контроль Природные источники углеводородов
Природные источники углеводородов Щелочноземельные металлы
Щелочноземельные металлы