Слайд 2Положение титана в периодической системе химических элементов и строение атома.
Титан

— элемент главной подгруппы IV группы. Его электронная формула следующая: +22Тi 1s2|2s22p6|3s23p63d2|4s2
Как и у многих других d-элементов, в атоме титана Тi подвижными являются не только электроны наружного энергетического уровня, но и два электрона d-подуровня. Поэтому титан в соединениях проявляет степени окисления + 2 и +4 (реже +3).
Слайд 3Нахождение в природе
Важнейшими минералами, содержащими титан, являются: титаномагнетиты FeTiO3 *nFe3O4, ильменит

FeTiO3, рутил TiO2 и др.
Титановые руды распространены относительно широко, но содержание в них титана небольшое.
Слайд 4Получение
Поскольку богатых титановых руд в земной коре нет, их приходится

обогащать.
Для получения титана концентрат обогащенных руд обрабатывают хлором в присутствии углерода:
TiO2+2Cl2+2C=TiCl4+2CO
Затем титан из хлорида титана (IV) восстанавливают натрием или магнием:
Слайд 5Получение
Полученный титан содержит примеси. Для выделения чистого титана образующуюся смесь нагревают

в вакууме. При этом магний и хлорид магния испаряются. Выделившийся титан переплавляют и получают компактный ковкий металл. Так как при этом производственном процессе используется дорогой металл магний Мg, себестоимость титана сравнительно велика.
Слайд 6Физические свойства
Титан — серебристо-белый металл.
Сравнительно легкий — немного тяжелее

алюминия, но примерно в три раза прочнее его.
Тугоплавкий (1665°С).
В обычных условиях отличается высокой прочностью и вязкостью.
Поддается различным видам обработки.
Слайд 7Химические свойства
Титан, как и алюминий, довольно активный металл. Однако благодаря

образованию на поверхности металла плотной защитной оксидной пленки он обладает исключительно высокой стойкостью против коррозии превышающей стойкость нержавеющей стали.
При обычных условиях на титан не действуют ни кислород воздуха, ни морская вода, ни даже царская водка. При повышенной температуре его химическая активность повышается. Так, например, титан реагирует с хлором:
Слайд 8Химические свойства
При высокой температуре реагирует с кислородом:
Азотная кислота на титан не

действует (кроме порошка), но серная кислота реагирует с ним.
С 50% -ной серной кислотой без нагревания одновременно протекают следующие реакции:
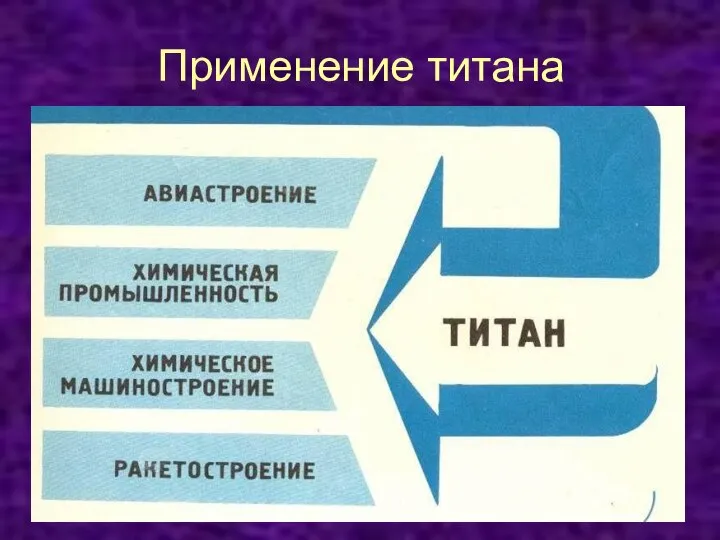
Слайд 10Применение
Титан и его сплавы в связи с их легкостью, прочностью,

термической и коррозионной стойкостью применяются для изготовления
деталей самолетов, космических кораблей, ракет, подводных лодок, трубопроводов, котлов высокого давления, различных аппаратов для химической промышленности.
Титан широко используется в виде листов для обшивки корпусов судов, обеспечивающих высокую прочность и стойкость в морской воде.
Слайд 11 Титан, как и тантал, не действует на живые ткани организма, поэтому
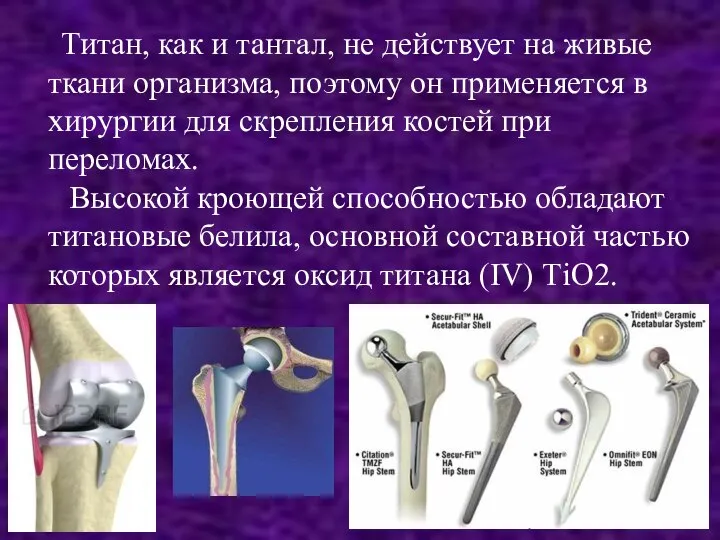
он применяется в хирургии для скрепления костей при переломах.
Высокой кроющей способностью обладают титановые белила, основной составной частью которых является оксид титана (IV) ТiO2.









 Про задачи. Химия 11 класс
Про задачи. Химия 11 класс Галогены. Возможные степени окисления
Галогены. Возможные степени окисления Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6]
Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6] Карбонильные соединения
Карбонильные соединения 9 кл Урок 7 Розчинність речовин
9 кл Урок 7 Розчинність речовин Основные химические понятия и законы химии. (Часть 2)
Основные химические понятия и законы химии. (Часть 2) Галогены. Элементы главной подгруппы 7 группы Периодической системы Менделеева
Галогены. Элементы главной подгруппы 7 группы Периодической системы Менделеева Карбоновые кислоты и их производные. (Лекция 11)
Карбоновые кислоты и их производные. (Лекция 11) Вода. Физические и химические свойства
Вода. Физические и химические свойства Презентация на тему Угольная кислота
Презентация на тему Угольная кислота  Идентификация Бензойной кислоты
Идентификация Бензойной кислоты Лучший тест для подготовки к ЕГЭ по химии
Лучший тест для подготовки к ЕГЭ по химии Аммиак. Состав вещества
Аммиак. Состав вещества Реакции этерификации
Реакции этерификации Подготовка к контрольной работе химические реакции 8 класс
Подготовка к контрольной работе химические реакции 8 класс Подача питательной воды в парогенератор при запроектной аварии
Подача питательной воды в парогенератор при запроектной аварии Урок по химии в 10 классе на тему: «Жиры» 2008 год.
Урок по химии в 10 классе на тему: «Жиры» 2008 год. 10-2 основные положения теории Бутлерова
10-2 основные положения теории Бутлерова Номенклатура органических соединений
Номенклатура органических соединений Рівновага в розчинах електролітів. Гідроліз солей. Буферні системи
Рівновага в розчинах електролітів. Гідроліз солей. Буферні системи 7609f31d31514fe19b6df19a98197139 (1)
7609f31d31514fe19b6df19a98197139 (1) Адсорбционно-десорбционные взаимодействия фосфатов кальция и аминокислот
Адсорбционно-десорбционные взаимодействия фосфатов кальция и аминокислот Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Изготовление индикаторной бумаги
Изготовление индикаторной бумаги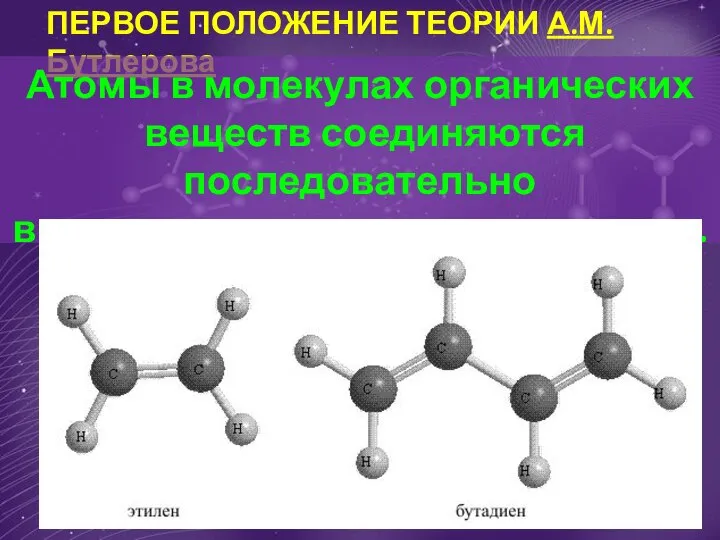 Первое положение теории А.М. Бутлерова Атомы в молекулах органических веществ соединяются последовательно
Первое положение теории А.М. Бутлерова Атомы в молекулах органических веществ соединяются последовательно Валентность
Валентность Консультация по химии
Консультация по химии Презентация на тему Законы газового состояния вещества
Презентация на тему Законы газового состояния вещества