Слайд 2Электролитическая диссоциация химических элементов
Демонстрационный эксперимент

Слайд 3Электролитическая диссоциация химических элементов

Слайд 4Электролитическая диссоциация химических элементов
Процесс распада электролита на ионы называется электролитической диссоциацией
1877 год

Слайд 5Электролитическая диссоциация химических элементов
Механизм диссоциации веществ с ионной связью

Слайд 6Электролитическая диссоциация химических элементов
Механизм диссоциации веществ с ковалентной полярной связью

Слайд 7Электролитическая диссоциация химических элементов
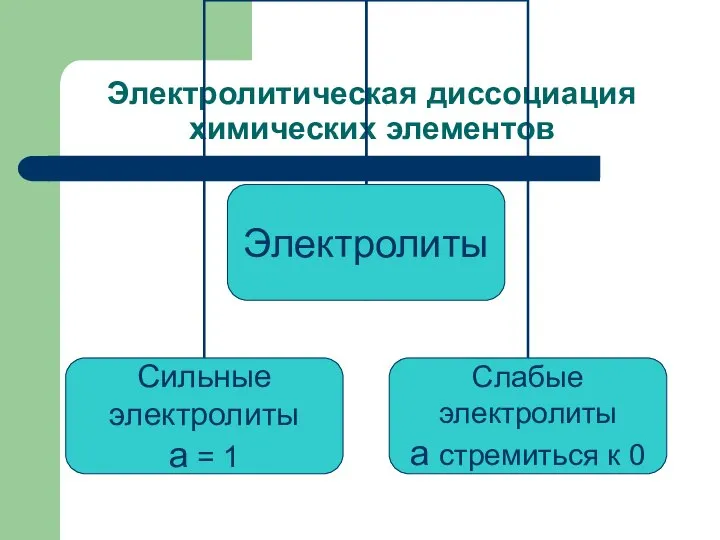
В растворе не все молекулы электролита распадаются на ионы,

поэтому растворы характеризуются степенью диссоциации, обозначается греческой буквой а («альфа»).
Степень диссоциации – это отношение числа частиц, распавшихся на ионы (Nд),
к общему числу растворенных частиц (Nр):
а = Nд/Nр
Слайд 8Электролитическая диссоциация химических элементов
Слайд 9Электролитическая диссоциация химических элементов
Сильные электролиты:
1) все растворимые соли;
2) сильные кислоты (H2SO4, HCl,

HNO3);
3) все щелочи (NaOH, KOH)
Слайд 10Электролитическая диссоциация химических элементов
Слабые электролиты:
слабые кислоты (H2S, H2CO3, HNO2);
водный раствор аммиака NH3

H2O;
вода
Слайд 11Электролитическая диссоциация химических элементов
Основные положения теории:
Электролиты при растворении в воде распадаются (диссоциируют)

на ионы – положительные и отрицательные.
Ионы находятся в более устойчивых электронных состояниях, чем атомы. Они могут состоять из одного атома – это простые ионы или из нескольких атомов – сложные ионы.
Слайд 12Электролитическая диссоциация химических элементов
Основные положения теории:
2. Причиной диссоциации электролита в водных растворах

является его гидратация, то есть взаимодействие электролита с молекулами воды и разрыв химической связи в нём.
Слайд 13Электролитическая диссоциация химических элементов
Основные положения теории:
3. При действии электрического тока ионы приобретают

направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные – к аноду. Поэтому первые называются
катионами (+), а вторые – анионами (-).
Направленное движение ионов
происходит в результате притяжения их
к противоположено заряженным
электродам.
Слайд 14Электролитическая диссоциация химических элементов
Основные положения теории:
4. Диссоциация – обратимый процесс: параллельно с

распадом молекул на ионы (диссоциацией) протекает процесс соединения ионов (ассоциация).
Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости.
Слайд 15Электролитическая диссоциация химических элементов
Кислоты диссоциируют на ионы водорода и кислотного остатка.

+ -
HCI = Н + CI
+ 2-
H2SO4 = 2H + SO4
Слайд 16Электролитическая диссоциация химических элементов
Соли диссоциируют на ионы металла и кислотного остатка

+ -
NaCI = Na + CI
+ 2-
Na2SO4 = 2Na + SO4
Слайд 17Электролитическая диссоциация химических элементов
Основания диссоциируют на ионы металла и гидроксид-ионы
+

-
Na OH = Na + OH
2+ -
Ca(OH)2 = Ca + 2OH
Слайд 18Электролитическая диссоциация химических элементов
Слабые многоосновные кислоты и основания, содержащие более одной гидроксидных

групп диссоциируют многоступенчато:
+ - + -
H3PO4 = H + H2PO4 Fe(OH)2 = FeOH + OH
- + 2- + 2+ -
H2PO4 = H + HPO4 FeOH = Fe + OH
2- + 3-
HPO4 = H + PO4
Слайд 19Электролитическая диссоциация химических элементов
Домашнее задание:
Написать уравнения диссоциации: сернистой кислоты, фосфорной кислоты, бромоводородной

кислоты, гидроксида бария, гидроксида калия, сульфата натрия, хлорида бария.


















 Железо в продуктах питания
Железо в продуктах питания Теория электролитической диссоциации
Теория электролитической диссоциации 897386 (2)
897386 (2) Подготовила Ковальчук О.М. учитель химии высшей квалификационной категории
Подготовила Ковальчук О.М. учитель химии высшей квалификационной категории Альдегиды. Состав. Строение. Свойства. Применение
Альдегиды. Состав. Строение. Свойства. Применение Окислительно-восстановительные реакции. Классификация ОВР
Окислительно-восстановительные реакции. Классификация ОВР Химия и космос
Химия и космос Закон постоянства состава веществ. Химические формулы. (8 класс)
Закон постоянства состава веществ. Химические формулы. (8 класс) Кислородосодержащие органические соединения. Cпирты (алканолы)
Кислородосодержащие органические соединения. Cпирты (алканолы) Химический элемент кислород
Химический элемент кислород Лакокрасочные материалы
Лакокрасочные материалы Положительно (+) заряженные частицы. Катионы
Положительно (+) заряженные частицы. Катионы Алюминий
Алюминий Cкорость химических реакций
Cкорость химических реакций Кислоты в химии
Кислоты в химии Pастворы, используемые в промышленности
Pастворы, используемые в промышленности Типичные реакции оснований
Типичные реакции оснований Искусственные полимеры
Искусственные полимеры Ароматические углеводороды
Ароматические углеводороды Органическая химия
Органическая химия атомно-молекулярное учение (1)
атомно-молекулярное учение (1) Презентация по Химии "Химическая номенклатура и филология"
Презентация по Химии "Химическая номенклатура и филология"  Спирттің сақталуы туралы айтып беріңіз. Көмірқышқылының амидтік туындылары туралы айтып беріңіз
Спирттің сақталуы туралы айтып беріңіз. Көмірқышқылының амидтік туындылары туралы айтып беріңіз Диаграммы состояния с ПФ. Диаграммы состояния с конгруэнтно плавящимися ПФ
Диаграммы состояния с ПФ. Диаграммы состояния с конгруэнтно плавящимися ПФ Увлекательный мир химии
Увлекательный мир химии Ar, Mr
Ar, Mr Теория валентных связей
Теория валентных связей Основные положения теории электролитической диссоциации
Основные положения теории электролитической диссоциации