Содержание
- 2. При электролизе растворов солей на катоде наблюдаются следующие закономерности: 1. Если металл в соли — активный
- 3. При электролизе растворов солей на аноде наблюдаются следующие закономерности: 1. Если на анод попадает бескислородный кислотный
- 5. Суммарные процессы электролиза
- 6. Электролиз расплавов
- 9. Скачать презентацию
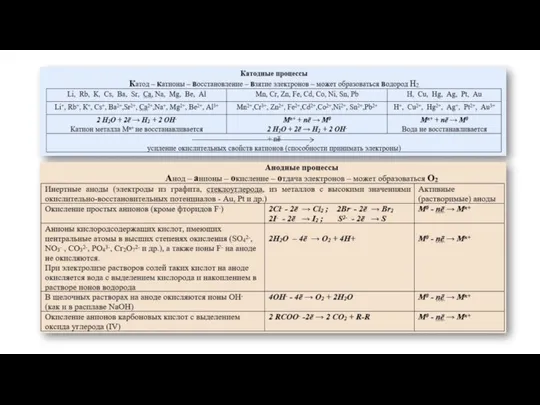
Слайд 2При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1. Если металл в соли
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1. Если металл в соли

включительно), то на катоде ионы металлов не восстанавливаются, идет процесс восстановления молекул воды:
2H2O +2ē → H2 + 2OH—
2. Если металл в соли – средней активности (между Al3+ и Н+), то на катоде восстанавливаются и ион металла, и молекулы воды :
Men+ + nē → Me0
2H+2O +2ē → H20 + 2OH—
Например, при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород: Fe2+ + 2ē → Fe0
2H+2O +2ē → H20 + 2OH—
3. Если металл в соли — неактивный (после H), то на катоде восстанавливается только ион металла: Men+ + nē → Me0
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu2+ + 2ē → Cu0
4. Если на катод попадают катионы водорода H+, то они и восстанавливаются до молекулярного водорода:
2H+ + 2ē → H20
Электролиз растворов
Катодные процессы
Слайд 3 При электролизе растворов солей на аноде
наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный остаток,
При электролизе растворов солей на аноде
наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный остаток,

неМеn- – nē = неМе0
Например: при электролизе раствора хлорида натрия на аноде окисляются хлорид-ионы:
2Cl— – 2ē = Cl20
Исключение: при электролизе растворов фторидов окисляются молекулы воды, а не фторид-ионы:
2H2O-2 – 4ē → O20+ 4H+
2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион, то окислению подвергается вода с выделением молекулярного кислорода:
2H2O-2 – 4ē → O20 + 4H+
Анодные процессы
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
4O-2H– – 4ē → O20 + 2H2O
4. При электролизе растворов солей карбоновых кислот окислению подвергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например, при электролизе растворов ацетатов
выделяется углекислый газ и этан:
2CH3C+3OO– –2ē → 2C+4O2+ CH3-CH3
Электролиз растворов
Слайд 5
Суммарные процессы электролиза
Суммарные процессы электролиза

Слайд 6Электролиз расплавов
Электролиз расплавов


 HCl - кислота
HCl - кислота Декоративная краска с эффектом окисленной меди
Декоративная краска с эффектом окисленной меди Окислительно-восстановительные реакции. Метод электронного баланса
Окислительно-восстановительные реакции. Метод электронного баланса Основы химической термодинамики
Основы химической термодинамики Биосинтез пиримидиновых нуклеотидов
Биосинтез пиримидиновых нуклеотидов Металлическая химическая связь
Металлическая химическая связь Органическая химия. Введение
Органическая химия. Введение Кислоты, основания и соли как электролиты
Кислоты, основания и соли как электролиты Молярная масса вещества
Молярная масса вещества Основания как электролиты
Основания как электролиты Номенклатура органических соединений. Упражнения
Номенклатура органических соединений. Упражнения Углеводороды: соединения, состоящие из углерода и водорода
Углеводороды: соединения, состоящие из углерода и водорода Презентация на тему Генетическая связь между классами неорганических веществ
Презентация на тему Генетическая связь между классами неорганических веществ  Сплавы металлов
Сплавы металлов Углеводороды
Углеводороды Pomalé a rýchle reakcie v bežnom živote
Pomalé a rýchle reakcie v bežnom živote Тренажёр: знаки химических элементов
Тренажёр: знаки химических элементов Серная кислота
Серная кислота ОВР
ОВР Оксиды. Физические свойства
Оксиды. Физические свойства Svins. Iegūšana
Svins. Iegūšana Основания
Основания Иерархия классов методов моделирования. Атомистические и микроскопические методы
Иерархия классов методов моделирования. Атомистические и микроскопические методы Важнейшие породообразующие минералы
Важнейшие породообразующие минералы Влияние давления на скорость химических реакций с участием газов
Влияние давления на скорость химических реакций с участием газов Вероятность протекания химических реакций
Вероятность протекания химических реакций Метод проектов: организация деятельности по химии
Метод проектов: организация деятельности по химии Металлы. Физические свойства металлов
Металлы. Физические свойства металлов