под влиянием внешних воздействий (электрическое поле, реагирующая частица и др.).
Другими словами, поляризуемость — это способность электронного облака связи к поляризации при действии внешнего электрического поля или электрически заряженных частиц. В результате внешних воздействий происходит деформация электронного облака связи, возрастает ее полярность (увеличивается дипольный момент).
Поляризуемость связей в молекуле оценивают величиной молекулярной рефракции (MRD), определяемой экспериментально на основании таких физических констант органических соединений, как показатель преломления nD20 и плотность d:
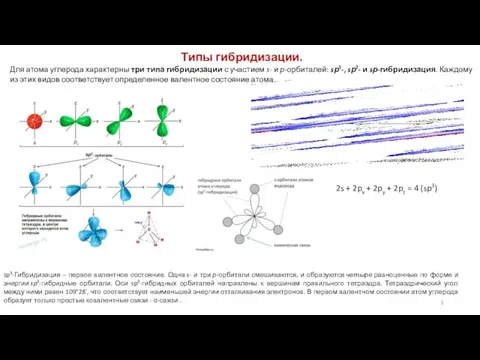
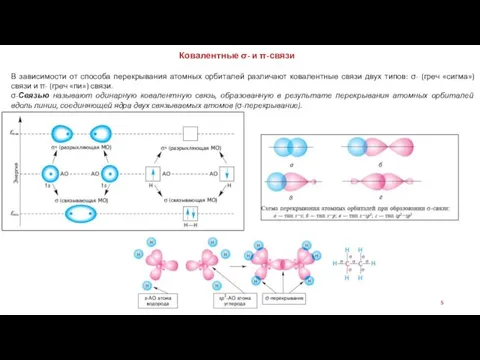
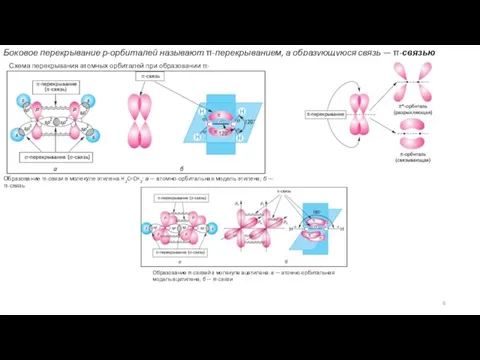
5. Направленность связей. Ковалентные связи имеют определенную направленность в пространстве. Электронные пары, образующие химические связи, стремятся занять такое пространственное положение относительно друг друга, чтобы силы электростатического отталкивания между ними были минимальными.
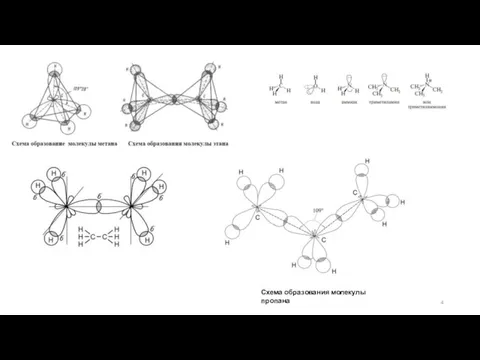
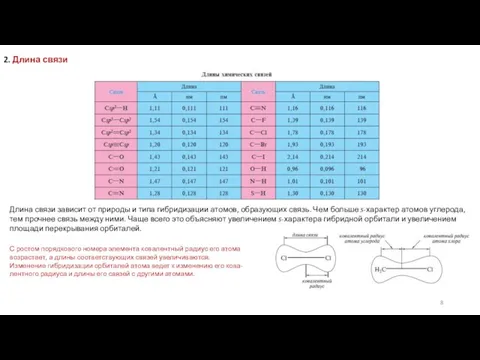
Углы между направлениями связей в молекуле называют валентными углами. Значение валентного угла зависит от состояния гибридизации атомных орбиталей и природы атомов, образующих связи. Так, углы между связями С—Н в метане составляют 109° 28′. Однако это справедливо только в тех случаях, когда атом углерода связан с четырьмя одинаковыми заместителями. В большинстве же случаев наблюдаются небольшие отклонения от угла правильного тетраэдра.














 Получение и химические свойства металлов
Получение и химические свойства металлов Магний
Магний Органические соединения в быту. Понятие о бытовых химикатах
Органические соединения в быту. Понятие о бытовых химикатах Презентация на тему Викторина "Узнай химический элемент"
Презентация на тему Викторина "Узнай химический элемент"  Применение центрифугирования
Применение центрифугирования Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Задачи. Химические элементы
Задачи. Химические элементы Презентация на тему Спирты (10 класс)
Презентация на тему Спирты (10 класс)  Презентация на тему Серная кислота
Презентация на тему Серная кислота  Значимые личности в химии
Значимые личности в химии Классификация химических реакций
Классификация химических реакций Водород – топливо будущего
Водород – топливо будущего Биохимия статическая, динамическая, функциональная
Биохимия статическая, динамическая, функциональная Основные классы неорганических соединений. Мы едем, едем, едем…
Основные классы неорганических соединений. Мы едем, едем, едем… Влияние на скорость ферментативной реакции
Влияние на скорость ферментативной реакции Биодизельное топливо
Биодизельное топливо электролитическая диссоциация
электролитическая диссоциация Гравиметрический анализ. Лекция 1
Гравиметрический анализ. Лекция 1 Органическая химия
Органическая химия Алкены. Химические и физические свойства
Алкены. Химические и физические свойства Современные сплавы на основе циркония
Современные сплавы на основе циркония Капрон
Капрон Прикладная геохимия
Прикладная геохимия Шаблон для презентации по химии
Шаблон для презентации по химии Физико-химическая механика и реология дисперсных структур. Лекция 15
Физико-химическая механика и реология дисперсных структур. Лекция 15 Презентация по химии на тему _Закон постоянства со
Презентация по химии на тему _Закон постоянства со Budowa pasmowa ciał stałych
Budowa pasmowa ciał stałych Презентация на тему Галогены и здоровье человека
Презентация на тему Галогены и здоровье человека