Содержание
- 2. 2 Непредельные (ненасыщенные) углеводороды ряда этилена (алкены, олефины) CnH2n С2Н2 – этилен, этен С3Н6 – пропилен,
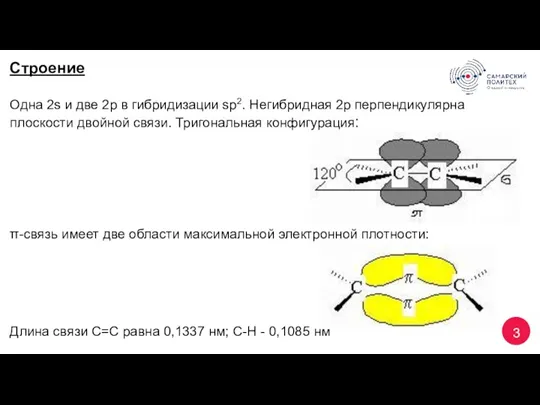
- 3. 3 Строение Одна 2s и две 2p в гибридизации sp2. Негибридная 2р перпендикулярна плоскости двойной связи.
- 4. 4 Изомерия 1. Углеродного скелета: 2. Положения двойной связи: 3. Пространственная: tкип = 3,5°С, μ= 0,33
- 5. 5 Номенклатура Систематические:названия алкенов производят от названий соответствующих алканов путём замены суффикс «-ан» на «-ен» Рациональная:
- 6. 6 Способы получения алкенов Крекинг – 15% алкенов (700°С) 2. Пиролиз метана: 3. Дегидрирование:
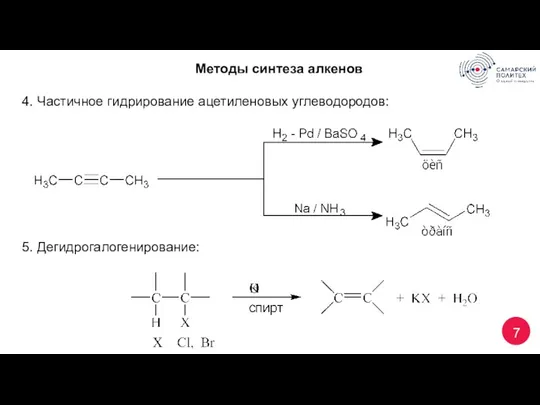
- 7. 7 Методы синтеза алкенов 4. Частичное гидрирование ацетиленовых углеводородов: 5. Дегидрогалогенирование:
- 8. 8 Правило Зайцева При дегидрогалогенировании галогеналканов и дегидратации спиртов водород отщепляется от наименее гидрогенизированного атома С
- 9. 9 Механизм Е1 (для третичных): υ = k[t-BuCl] -Cl- трет-бутил-катион
- 10. 10 Механизм Е2 (для первичных и вторичных): υ= k[OH-][RBr]
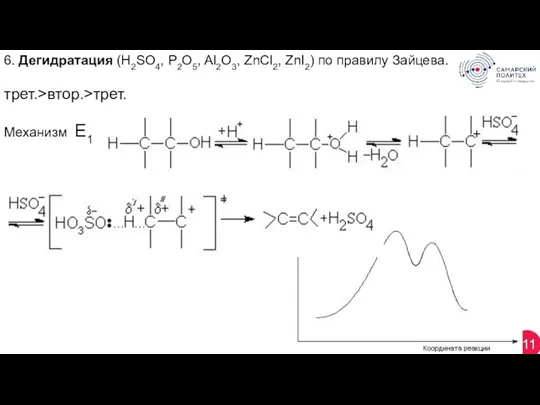
- 11. 11 6. Дегидратация (H2SO4, P2O5, Al2O3, ZnCl2, ZnI2) по правилу Зайцева. трет.>втор.>трет. Механизм Е1
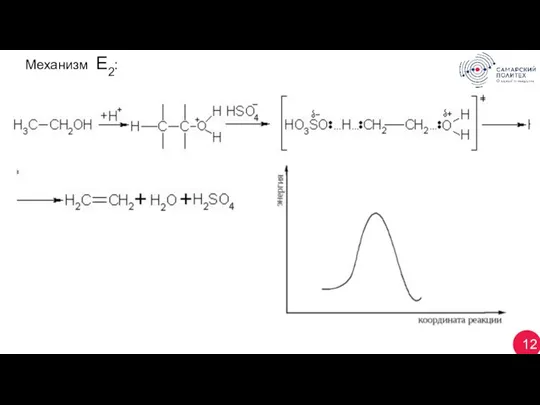
- 12. 12 Механизм Е2:
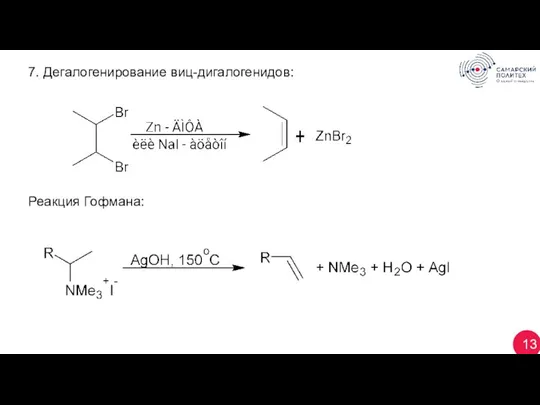
- 13. 13 7. Дегалогенирование виц-дигалогенидов: Реакция Гофмана:
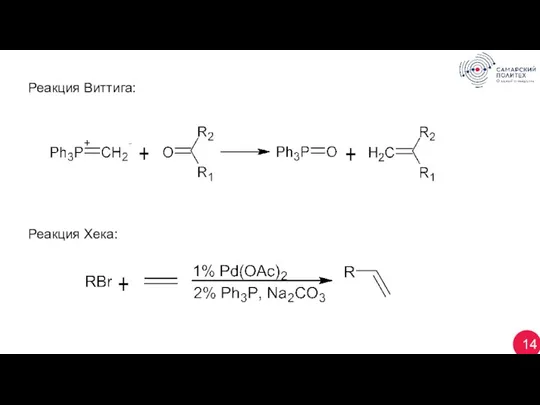
- 14. 14 Реакция Виттига: Реакция Хека:
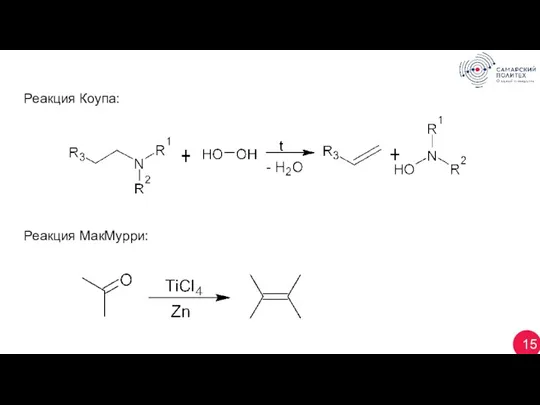
- 15. 15 Реакция Коупа: Реакция МакМурри:
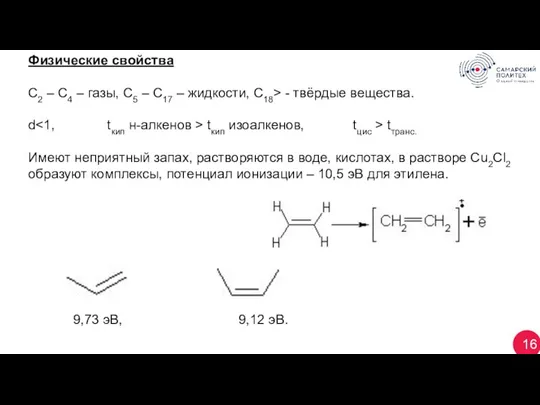
- 16. 16 Физические свойства С2 – С4 – газы, С5 – С17 – жидкости, С18> - твёрдые
- 17. 17 Химические свойства Реакции присоединения (собственно присоединение, окисление, полимеризация) и замещения 1. Присоединение 1.1 Гидрирование по
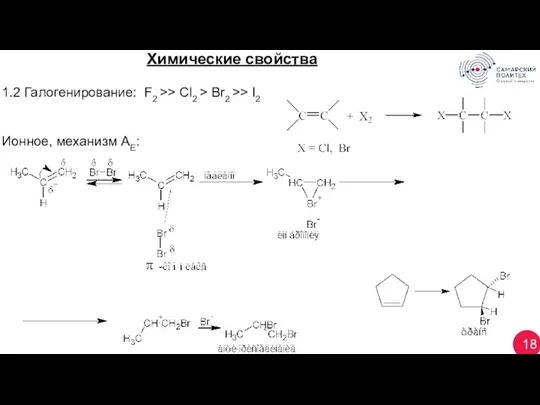
- 18. 18 Химические свойства 1.2 Галогенирование: F2 >> Cl2 > Br2 >> I2 Ионное, механизм АЕ:
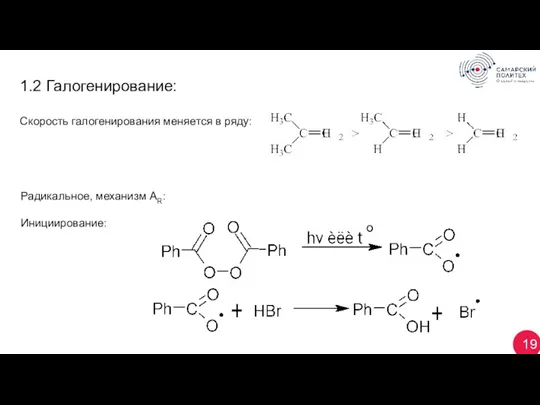
- 19. 19 Радикальное, механизм AR: Инициирование: 1.2 Галогенирование: Скорость галогенирования меняется в ряду:
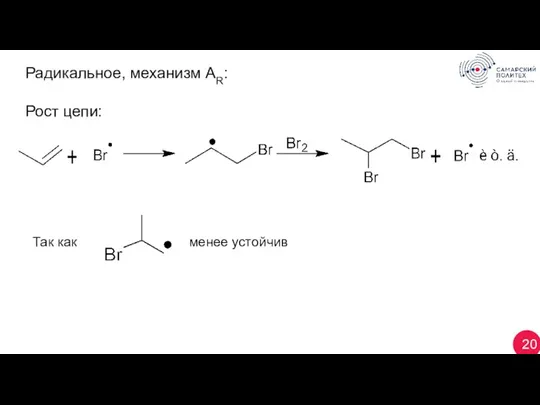
- 20. 20 Радикальное, механизм AR: Рост цепи: Так как менее устойчив
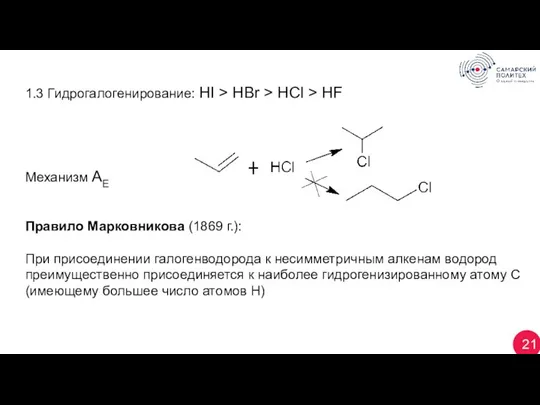
- 21. 21 1.3 Гидрогалогенирование: HI > HBr > HCl > HF Механизм АЕ Правило Марковникова (1869 г.):
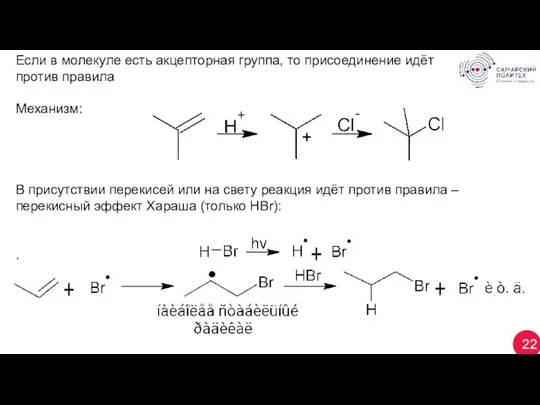
- 22. 22 Если в молекуле есть акцепторная группа, то присоединение идёт против правила Механизм: В присутствии перекисей
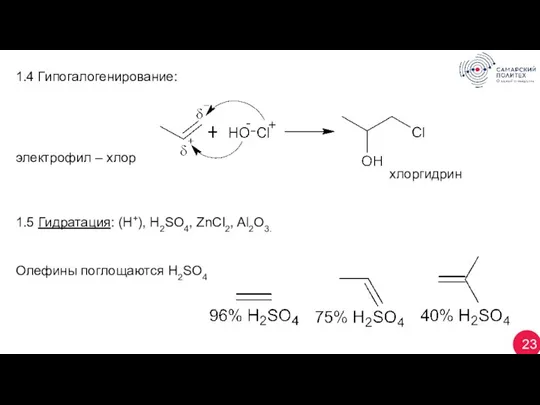
- 23. 23 1.4 Гипогалогенирование: электрофил – хлор хлоргидрин 1.5 Гидратация: (Н+), H2SO4, ZnCl2, Al2O3. Олефины поглощаются H2SO4
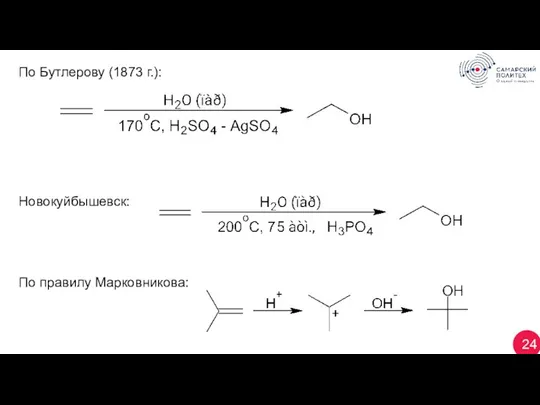
- 24. 24 По Бутлерову (1873 г.): Новокуйбышевск: По правилу Марковникова:
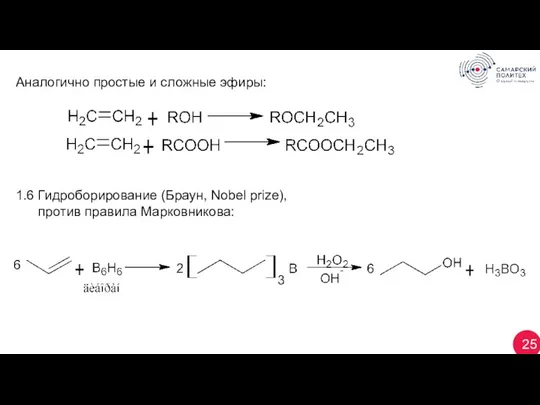
- 25. 25 Аналогично простые и сложные эфиры: 1.6 Гидроборирование (Браун, Nobel prize), против правила Марковникова:
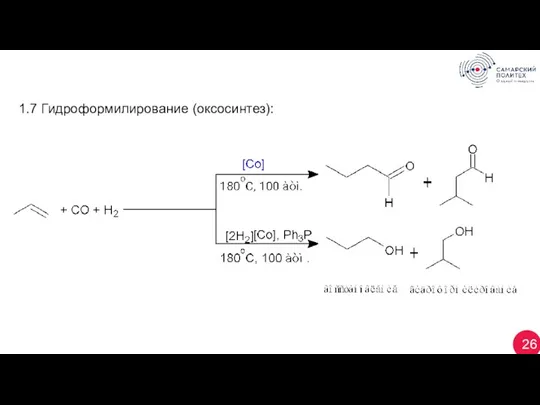
- 26. 26 1.7 Гидроформилирование (оксосинтез):
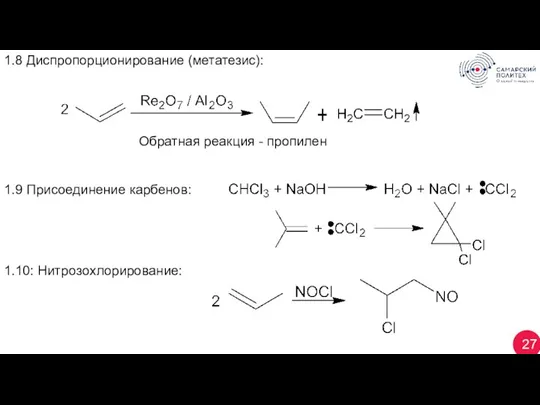
- 27. 27 1.8 Диспропорционирование (метатезис): Обратная реакция - пропилен 1.9 Присоединение карбенов: 1.10: Нитрозохлорирование:
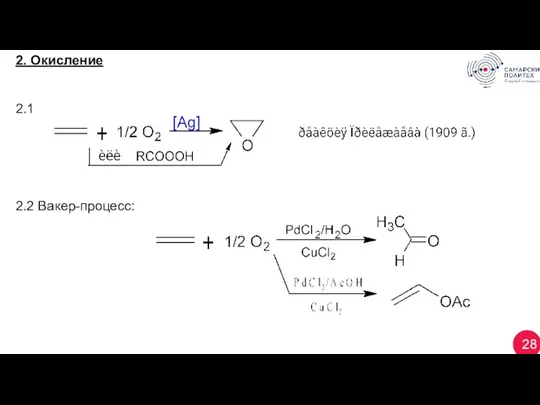
- 28. 28 2. Окисление 2.1 2.2 Вакер-процесс:
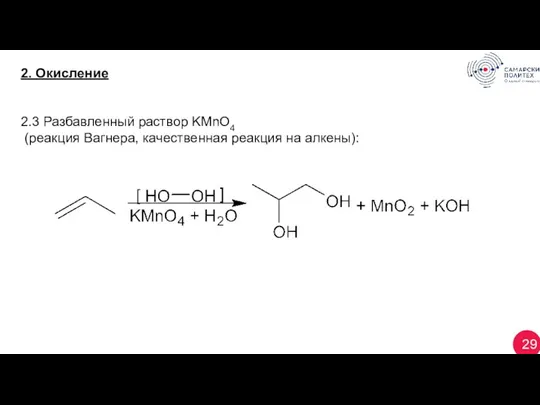
- 29. 29 2. Окисление 2.3 Разбавленный раствор KМnO4 (реакция Вагнера, качественная реакция на алкены):
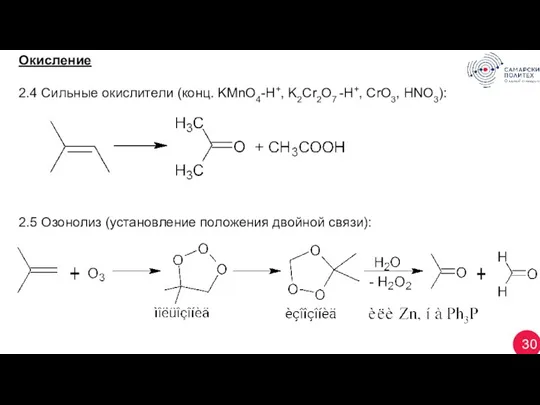
- 30. 30 Окисление 2.4 Сильные окислители (конц. KМnO4-H+, K2Cr2O7 -H+, CrO3, HNO3): 2.5 Озонолиз (установление положения двойной
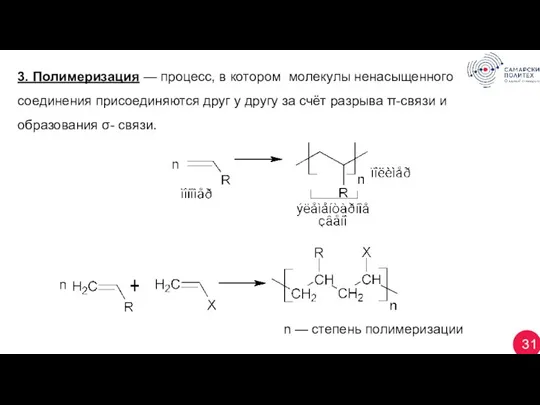
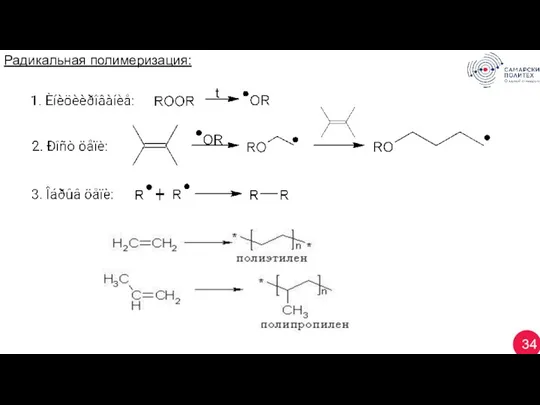
- 31. 31 3. Полимеризация — процесс, в котором молекулы ненасыщенного соединения присоединяются друг у другу за счёт
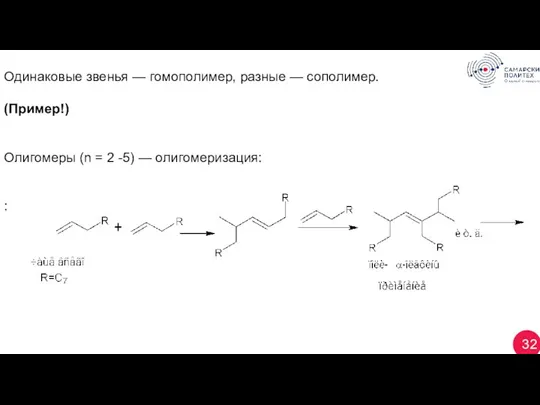
- 32. 32 Одинаковые звенья — гомополимер, разные — сополимер. (Пример!) Олигомеры (n = 2 -5) — олигомеризация:
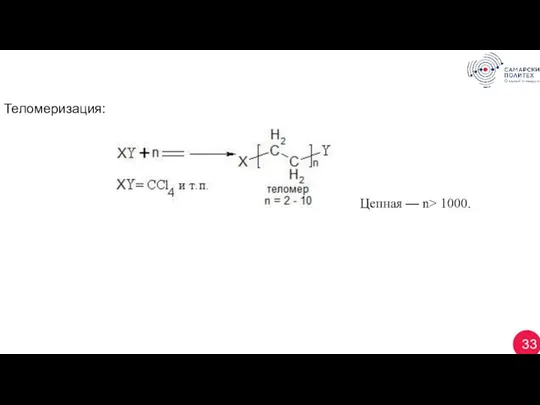
- 33. 33 Теломеризация: Цепная — n> 1000.
- 34. 34 Радикальная полимеризация:
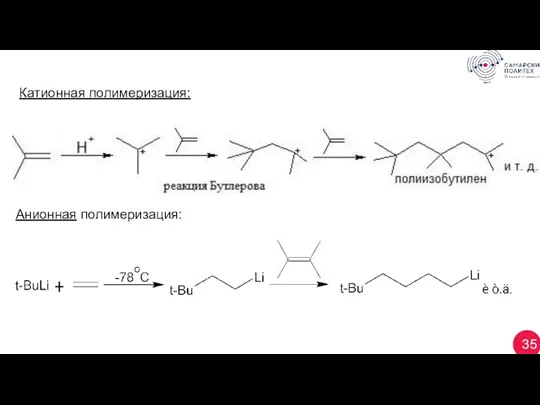
- 35. 35 Катионная полимеризация: Анионная полимеризация:
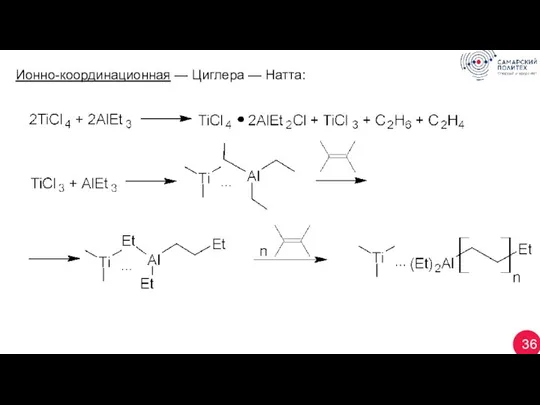
- 36. 36 Ионно-координационная — Циглера — Натта:
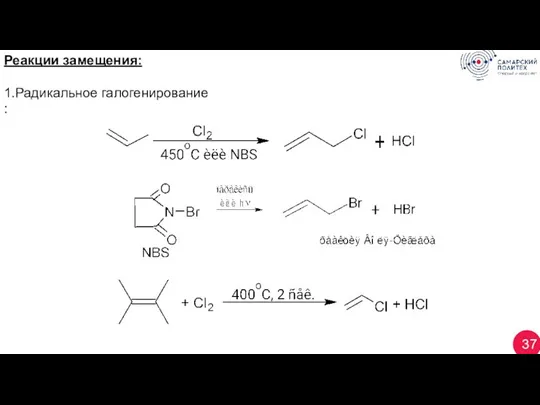
- 37. 37 Реакции замещения: 1.Радикальное галогенирование :
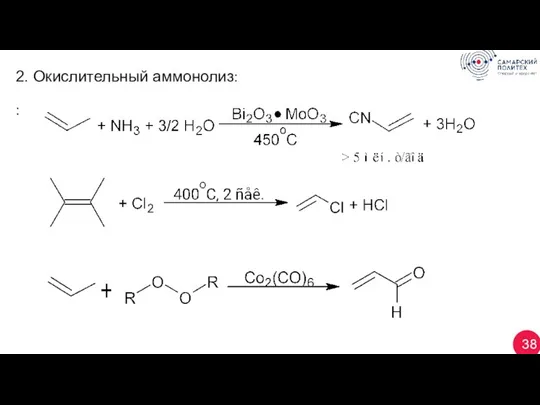
- 38. 38 2. Окислительный аммонолиз: :
- 40. Скачать презентацию





![9 Механизм Е1 (для третичных): υ = k[t-BuCl] -Cl- трет-бутил-катион](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1012505/slide-8.jpg)
![10 Механизм Е2 (для первичных и вторичных): υ= k[OH-][RBr]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1012505/slide-9.jpg)

 Современная аналитическая химия.Учебная литература
Современная аналитическая химия.Учебная литература Высшие жирные кислоты липиды биомембраны. Лекция 3
Высшие жирные кислоты липиды биомембраны. Лекция 3 Презентация на тему Аммиак
Презентация на тему Аммиак  Органическая химия
Органическая химия 8_ANIONY_2_3_angr
8_ANIONY_2_3_angr Электролиз и его применение
Электролиз и его применение Презентация на тему Моющие средства
Презентация на тему Моющие средства  Разнообразие азотсодержащих органических веществ
Разнообразие азотсодержащих органических веществ Калийные удобрения
Калийные удобрения Разветвленные цепные реакции
Разветвленные цепные реакции Основания и их свойства
Основания и их свойства Валентность
Валентность Оксиды. Классификация и химические свойства
Оксиды. Классификация и химические свойства Закон сохранения массы веществ. Типы химических реакций
Закон сохранения массы веществ. Типы химических реакций Водородная химическая связь
Водородная химическая связь Фестиваль песчаных скульптур
Фестиваль песчаных скульптур lektsia_7
lektsia_7 Презентация на тему Коррозия металлов
Презентация на тему Коррозия металлов  Строение атома Степень окисления. Валентность. Ионы
Строение атома Степень окисления. Валентность. Ионы Презентация на тему Использование информационных технологий на уроках химии
Презентация на тему Использование информационных технологий на уроках химии  Интересные свойства пластика
Интересные свойства пластика Русские ученые- химики
Русские ученые- химики Проведение лабраторных общеклинических исследований
Проведение лабраторных общеклинических исследований Принципы строения молекулы дезоксирибонуклеиновой кислоты: комплементарность нуклеотидов
Принципы строения молекулы дезоксирибонуклеиновой кислоты: комплементарность нуклеотидов Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Молярный объем
Молярный объем Презентация по Химии "Соединения алюминия"
Презентация по Химии "Соединения алюминия"  Классы неорганических соединений (основания)
Классы неорганических соединений (основания)