Слайд 3Энергия Гиббса
Свободная энергия Гиббса
(потенциал Гиббса, или термодинамический потенциал в узком смысле)

— это величина, изменение которой в ходе химической реакции равно изменению внутренней энергии системы.
Слайд 41) ΔG= Gкон. – Gисх.
2) ΔG = ΔH– TΔS
Энтропийный фактор (ТΔS) –

стремление системы к хаотичному и вероятному состоянию
Слайд 5Если (ΔG<0), то реакция протекает самопроизвольно в прямом направлении.
Если (ΔG=0), то реакция

находится в равновесном состоянии.
Если (ΔG>0), то реакция протекать самопроизвольно в прямом направлении не может. Однако обратная реакция идет самопроизвольно.
Слайд 6Значения изменения энергии Гиббса при стандартных условиях – концентрации равны 1 моль/л,

парциальное давление газообразных веществ равно 101,3 кПа, температура 298,15 К.
Слайд 7ΔG0р-ции = Σ ΔG0прод. — Σ ΔG0исх.

Слайд 8Энтальпийный и энтропийный факторы и направление процесса

Слайд 9Энтропия - мера неупорядоченности системы.
Энтальпия - запас энергии вещества









 Prezentatsia_Microsoft_PowerPoint (1)
Prezentatsia_Microsoft_PowerPoint (1) 12 принципов зелёной химии
12 принципов зелёной химии Определение содержание фосфатов в воде фотометрическим методом
Определение содержание фосфатов в воде фотометрическим методом Презентация на тему Свойства черных и цветных металлов
Презентация на тему Свойства черных и цветных металлов  Кинетическое лимитирование роста и жизненные стратегии микроорганизмов
Кинетическое лимитирование роста и жизненные стратегии микроорганизмов Липиды
Липиды Кремний Полупроводники в электронике_Горб
Кремний Полупроводники в электронике_Горб Неметаллы. Особенности электронного строения атомов НМ
Неметаллы. Особенности электронного строения атомов НМ Лекарственные растения содержащие флавоноиды
Лекарственные растения содержащие флавоноиды ОВР в гетерогенных системах
ОВР в гетерогенных системах Общая характеристика МЕТАЛЛОВ
Общая характеристика МЕТАЛЛОВ Изучение процесса замерзания воды
Изучение процесса замерзания воды Взаимодействие кислот с металлами. Кислоты-окислители
Взаимодействие кислот с металлами. Кислоты-окислители 7609f31d31514fe19b6df19a98197139 (1)
7609f31d31514fe19b6df19a98197139 (1) Сера
Сера Разработка методики расчета фазового равновесия при длительном хранении СПГ
Разработка методики расчета фазового равновесия при длительном хранении СПГ Алканы: строение, номенклатура, изомерия, физические свойства
Алканы: строение, номенклатура, изомерия, физические свойства 98675992
98675992 Ионо-дисперсное состояние микрокомпонентов в растворах
Ионо-дисперсное состояние микрокомпонентов в растворах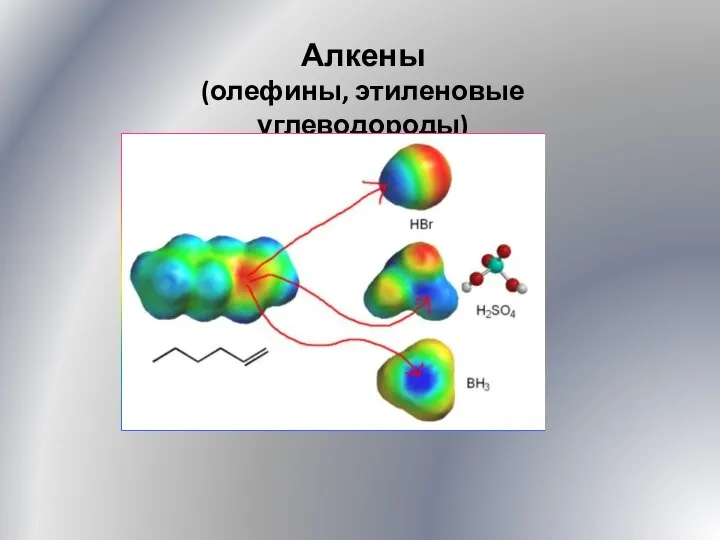 Алкены. Олефины, этиленовые углеводороды. (Лекция 5)
Алкены. Олефины, этиленовые углеводороды. (Лекция 5) Metals Properties and compounds
Metals Properties and compounds Исследование интерактивной компьютерной химической модели
Исследование интерактивной компьютерной химической модели Алканы
Алканы Типичные ошибки, допускаемые учащимися при выполнении задания повышенного уровня сложности С-5 ЕГЭ по химии
Типичные ошибки, допускаемые учащимися при выполнении задания повышенного уровня сложности С-5 ЕГЭ по химии Экологические характеристики ДВС
Экологические характеристики ДВС Гетерогенные химические системы и поверхностные явления в них
Гетерогенные химические системы и поверхностные явления в них Карбонильные производные (кислоты, альдегиды, кетоны, сложные эфиры)
Карбонильные производные (кислоты, альдегиды, кетоны, сложные эфиры) Презентация на тему Применение солей
Презентация на тему Применение солей