Слайд 2ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ И ПРОЦЕССЫ
ОВР – реакции, в которых изменяются степени окисления элементов,

то есть электроны переходят от одного атома или вещества (восстановителя) к другому (окислителю).
Слайд 3ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ И ПРОЦЕССЫ
А степень окисления – это заряд, который имел бы

атом, если бы все образованные им полярные связи стали ионными. Если связи действительно ионные, то с.о. совпадает с зарядом элементарного иона, например, K+F-. Если не все связи ионные, то степень окисления – это условное понятие, не имеющее строгого смысла, но полезное.
Но во многих случаях удается провести ОВР так, что восстановитель и окислитель разделены в пространстве, и заряды передаются через проводники. Тогда можно экспериментально зарегистрировать перенос заряда (токи, напряжения) и определить, сколько именно электронов передается. ОВР становится реальным, а не условным, понятием.
Слайд 4Гетерогенные системы
Гетерогенная система – система, состоящая из двух или большего числа фаз.
Химические реакции,

протекающие на границе раздела фаз, называются гетерогенными химическими реакциями. При равенстве скоростей прямой и обратной реакции наступает химическое равновесие в гетерогенной системе.
С(к) + 2Н2О = СО2 + 2Н2 , МеО(к) + Н2 = Ме(к) + Н2 О.



 Химическая реакция
Химическая реакция Алотропия углерода
Алотропия углерода Химия и космос
Химия и космос Витамины и их роль в жизни людей
Витамины и их роль в жизни людей Химическое многоборье. 9 класс
Химическое многоборье. 9 класс Stroenie_atoma__1
Stroenie_atoma__1 Ароматические углеводороды - Арены
Ароматические углеводороды - Арены Чистые вещества и смеси
Чистые вещества и смеси Химический элемент Li
Химический элемент Li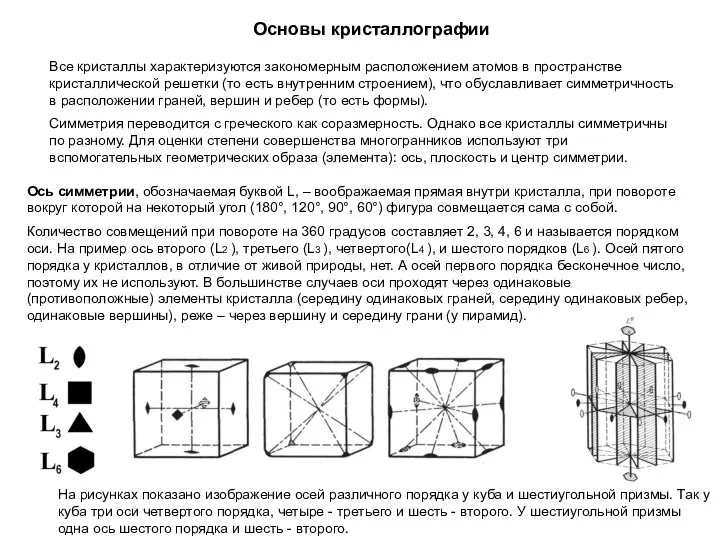 Основы кристаллографии
Основы кристаллографии Общая химическая технология. Определение размеров реакторов. Практическое занятие 8
Общая химическая технология. Определение размеров реакторов. Практическое занятие 8 Урок № 4
Урок № 4 Получение гидроген хлорида
Получение гидроген хлорида Презентация на тему Угарный газ
Презентация на тему Угарный газ  Диффузия в газах, жидкостях и твердых телах
Диффузия в газах, жидкостях и твердых телах Презентация на тему Оксид кремния
Презентация на тему Оксид кремния  Химическая связь и строение молекул
Химическая связь и строение молекул Аргументы к апелляции на ЕГЭ по химии 2021
Аргументы к апелляции на ЕГЭ по химии 2021 Обозначения групп симметрии по Шенфлису
Обозначения групп симметрии по Шенфлису Диэлектрики
Диэлектрики Алюминий. Из истории открытия
Алюминий. Из истории открытия Ковалентная неполярная связь
Ковалентная неполярная связь Минералы и их свойства
Минералы и их свойства 9 кл Урок 14 Ступінь дисоціації
9 кл Урок 14 Ступінь дисоціації Электромагнитное облучение. Радиоактивное загрязнение
Электромагнитное облучение. Радиоактивное загрязнение Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Элемент протактиний
Элемент протактиний Хим_10_30_Производство_аммиака
Хим_10_30_Производство_аммиака