Содержание
- 2. Содержание лекции Состояние микрокомпонентов в водных растворах. Ионо-дисперсные формы. Комплексные соединения. Устойчивость комплексных соединений. Образование гидроксосоединений.
- 3. Состояние микрокомпонентов в водных растворах Под термином "состояние" в радиохимии подразумевается совокупность всех форм, образованных радионуклидом
- 4. Ионо-дисперсные формы К ионо-дисперсным формам относятся простые акваионы, моноядерные, полиядерные и гетрополиядерные комплексы. Описание ионо-дисперсных форм
- 5. Равновесие реакций комплексообразования В общем случае образование комплексного соединения можно выразить следующим уравнением: Термодинамическая константа комплексообразования:
- 6. Константы комплексообразования Константы образования: ступенчатые Ki; общие βi Константы нестойкости: ступенчатые k; общие
- 7. Связь между константами и аналитически измеряемыми величинами Общая концентрация металла в растворе: Введя получаем N –
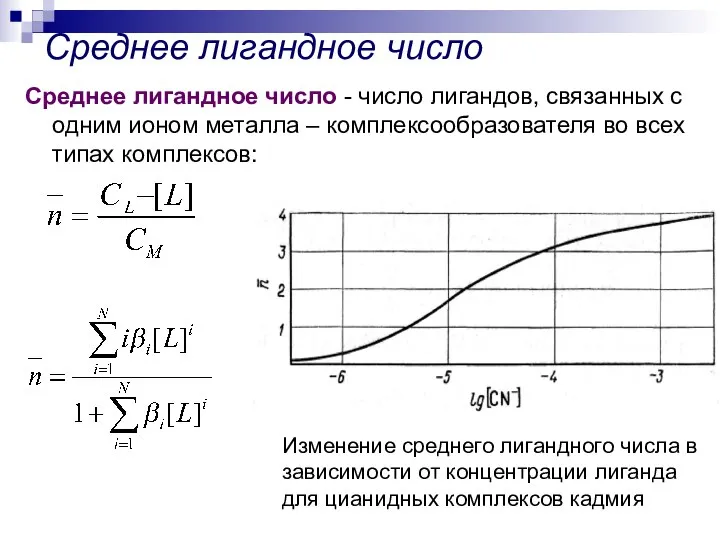
- 8. Среднее лигандное число Среднее лигандное число - число лигандов, связанных с одним ионом металла – комплексообразователя
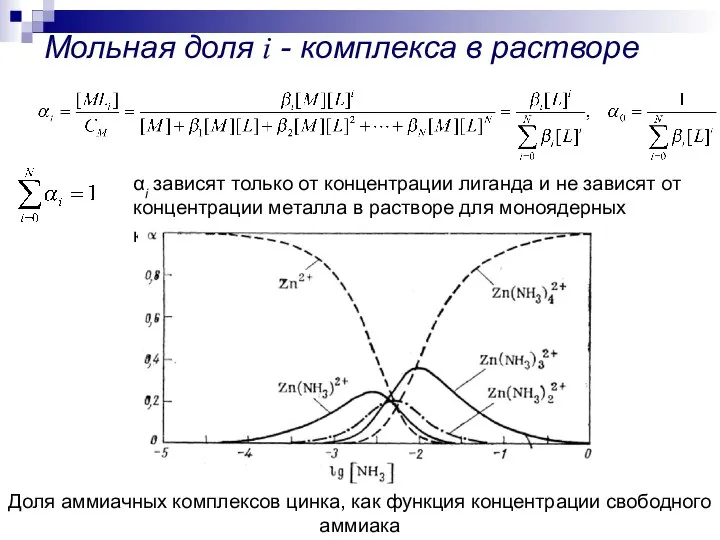
- 9. Мольная доля i - комплекса в растворе αi зависят только от концентрации лиганда и не зависят
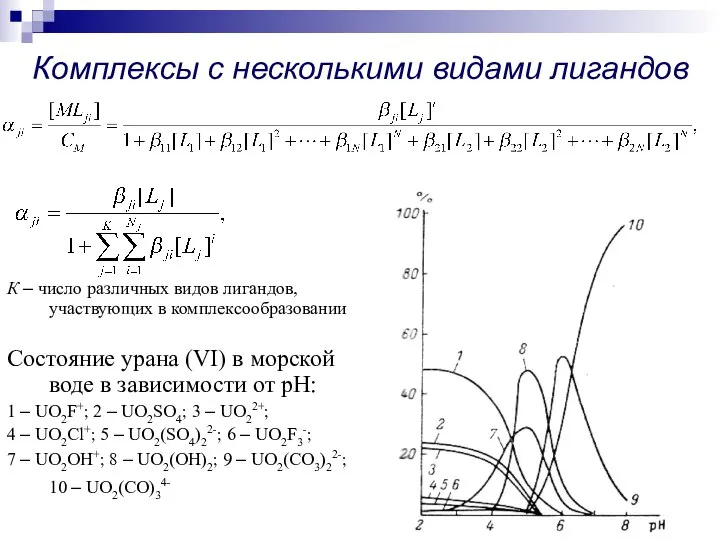
- 10. Комплексы с несколькими видами лигандов К – число различных видов лигандов, участвующих в комплексообразовании Состояние урана
- 11. Внешнесферные и внутрисферные комплексы Внутрисферные комплексы образуются в результате проявления сил близкодействия, что приводит к молекулярному
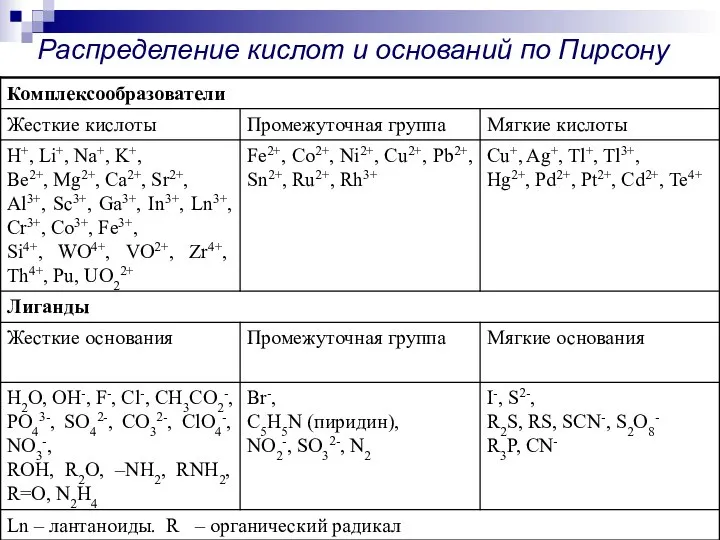
- 12. Концепция «жестких» и «мягких» кислот и оснований Пирсона Кроме ковалентной связи при образовании комплекса рассматриваются другие
- 13. Образование комплексных соединений Анализируя константы устойчивости комплексов, можно сделать вывод, что жесткие кислоты образуют наиболее прочные
- 14. Распределение кислот и оснований по Пирсону
- 15. Внутрикомплексные соединения Лиганды, которые могут предоставить две или более электронных пар центральному атому для образования комплекса
- 16. Устойчивость комплексных соединений [Cu(H2O)4]2+ + 4NH3 ↔ [Cu(NH3)4]2+ + 4H2O (1) [Cu(H2O)4]2+ + 2en ↔ [Cu(en)2]2+
- 17. Кинетика процесса Рассмотрим две реакции с участием в качестве лигандов аммиака и этилендиамина: M + 2NH3
- 18. Образование комплексов в присутствии различных лигандов Определяется соотношением констант устойчивости соответствующих комплексных соединений. В зависимости от
- 19. Образование гидроксосоединений свойственно большинству элементов, которые традиционно представляют интерес для радиохимии, химии и технологии редких, рассеянных
- 20. Каждую ступень можно охарактеризовать ступенчатой константой, а в общем виде – общей константой образования гидроксокомплексов. Образование
- 21. γi – ступенчатые константы гидролиза. Константа гидролиза общая: Связь между константами гидролиза и константами образования гидроксокомплексов
- 22. Реакция протолиза – это реакция отщепления протона от координированной молекулы воды: Информация о механизме физико-химического процесса
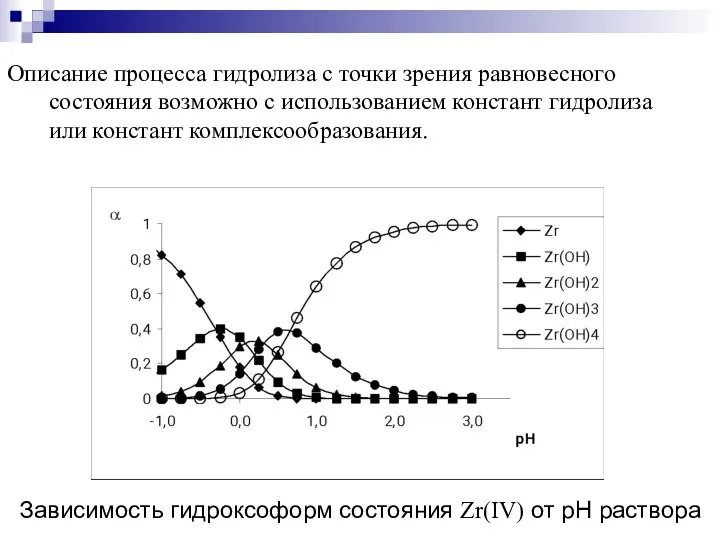
- 23. Описание процесса гидролиза с точки зрения равновесного состояния возможно с использованием констант гидролиза или констант комплексообразования.
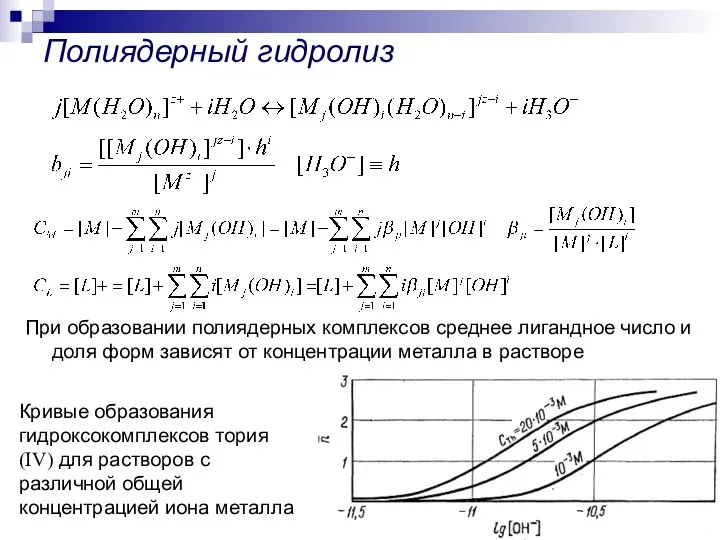
- 24. При образовании полиядерных комплексов среднее лигандное число и доля форм зависят от концентрации металла в растворе
- 25. Условия образования полиядерных комплексов Нижний концентрационный предел, после достижения которого должны образовываться только моноядерные комплексы, зависит
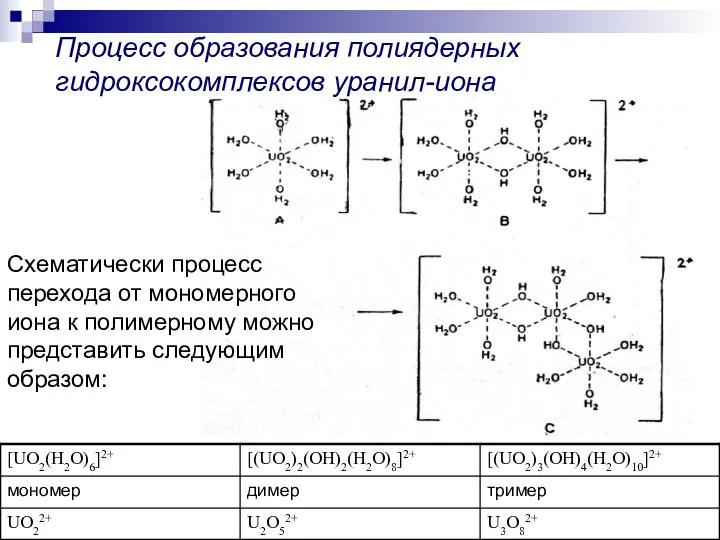
- 26. Схематически процесс перехода от мономерного иона к полимерному можно представить следующим образом: Процесс образования полиядерных гидроксокомплексов
- 27. Оляция, оксоляция, замещение анионами Последовательный переход от мономерного иона к полимерному происходит в результате протолиза и
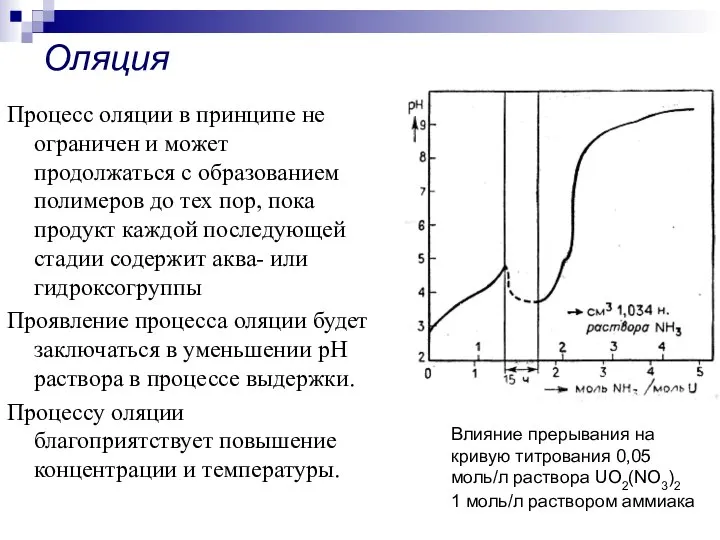
- 28. Процесс оляции в принципе не ограничен и может продолжаться с образованием полимеров до тех пор, пока
- 29. Процесс оксоляции - превращение оловых групп в оксо-группы путем отщепления ионов водорода: → + Н+. Деоксоляция
- 30. Выводы Рассмотрены основные закономерности образования ионо-дисперсных форм Проанализирован алгоритм расчета форм состояния микрокомпонентов в растворе. Рассмотрены
- 32. Скачать презентацию










![Устойчивость комплексных соединений [Cu(H2O)4]2+ + 4NH3 ↔ [Cu(NH3)4]2+ + 4H2O (1) [Cu(H2O)4]2+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/983789/slide-15.jpg)










 Структура периодической таблицы
Структура периодической таблицы Конструирование макромолекул методом ATRP
Конструирование макромолекул методом ATRP строение атома углерода. Валентные состояния атома углерода
строение атома углерода. Валентные состояния атома углерода Арены. Бензол
Арены. Бензол Александрит
Александрит Кислоты
Кислоты Презентация на тему Глюкоза (10 класс)
Презентация на тему Глюкоза (10 класс)  Альфа- и бета- распад. Правило смещения
Альфа- и бета- распад. Правило смещения Производство концентрированной азотной кислоты (лекция 15)
Производство концентрированной азотной кислоты (лекция 15) Роль металлов в искусстве
Роль металлов в искусстве Теория электронных смещений в органических молекулах
Теория электронных смещений в органических молекулах Алкадиены. Закрепление пройденного материала
Алкадиены. Закрепление пройденного материала Ковалентная связь. Радикалы
Ковалентная связь. Радикалы Углерод. 9 класс
Углерод. 9 класс Эпоксидті полимер материалдарының қасиеттерін зерттеу
Эпоксидті полимер материалдарының қасиеттерін зерттеу Презентация на тему Органическая химия. История развития
Презентация на тему Органическая химия. История развития  Нефть. Черное золото или черная смерть
Нефть. Черное золото или черная смерть Строение электронных оболочек
Строение электронных оболочек Окислительно- восстановительные реакции в органической химии. Подготовка к ЕГЭ
Окислительно- восстановительные реакции в органической химии. Подготовка к ЕГЭ Общие сведения о металлах и сплавах. (7 класс)
Общие сведения о металлах и сплавах. (7 класс) Предмет органической химии
Предмет органической химии Любовь и химия
Любовь и химия Эфирные масла
Эфирные масла Соединения азота в атмосфере. Лекция 4
Соединения азота в атмосфере. Лекция 4 Химическое равновесие в гомогенных системах
Химическое равновесие в гомогенных системах Липиды. Омыляемые липиды. Рубежный контроль №2
Липиды. Омыляемые липиды. Рубежный контроль №2 Значение химии в медицине
Значение химии в медицине Химическая связь. Строение вещества
Химическая связь. Строение вещества