Содержание
- 2. Лекция №5 1. Строение алкенов 2. Номенклатура алкенов 3. Изомерия 4. Физические свойства алкенов
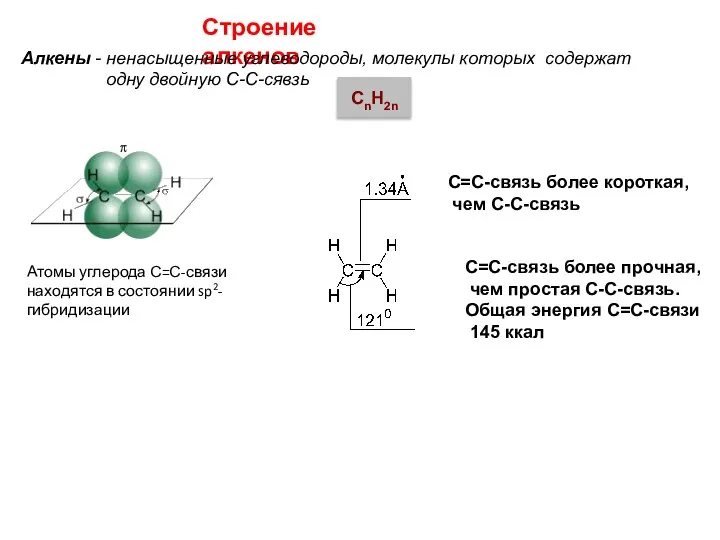
- 3. Атомы углерода С=С-связи находятся в состоянии sp2-гибридизации С=С-связь более короткая, чем С-С-связь С=С-связь более прочная, чем
- 4. Виды гибридизации sp3 — гибридизация (алканы); sp2 — гибридизация (алкены); sp — гибридизация и (алкины) Гибридизация
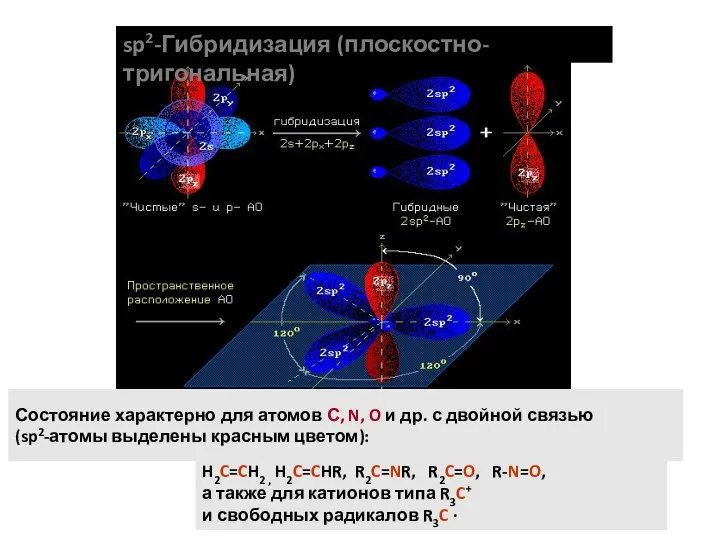
- 5. sp2-Гибридизация (плоскостно-тригональная) Состояние характерно для атомов С, N, O и др. с двойной связью (sp2-атомы выделены
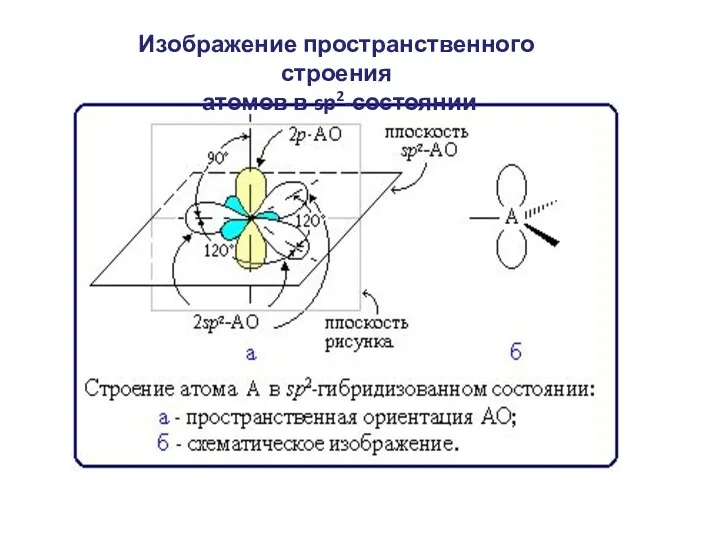
- 6. Изображение пространственного строения атомов в sp2-состоянии
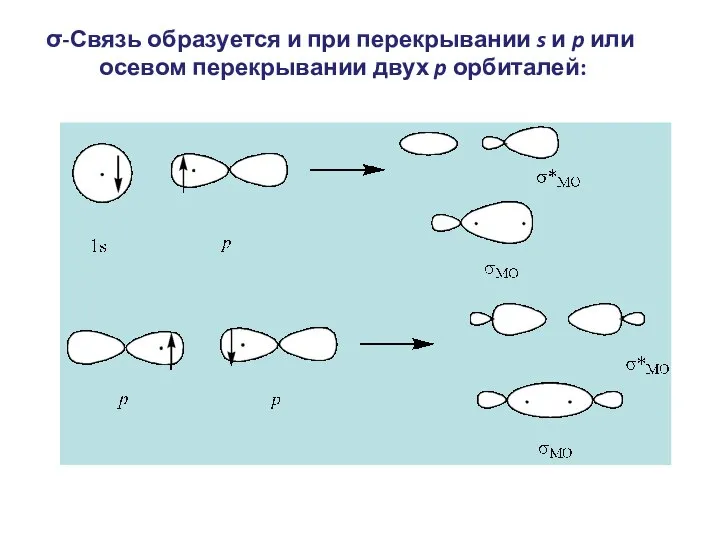
- 7. σ-Связь образуется и при перекрывании s и p или осевом перекрывании двух p орбиталей:
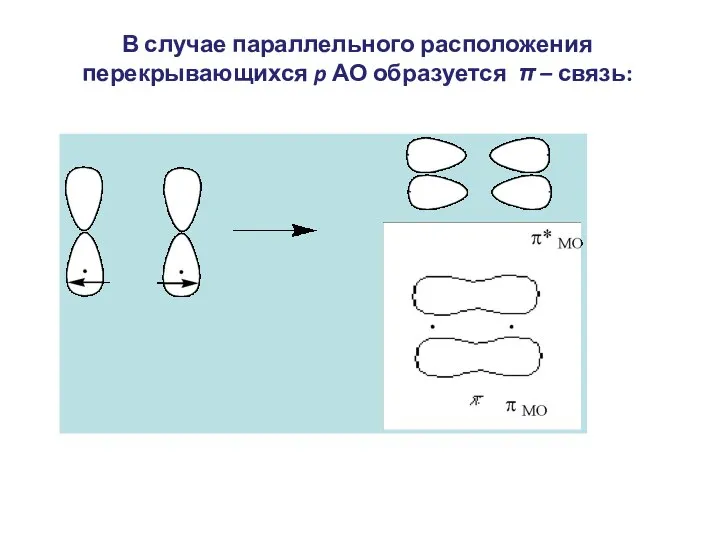
- 8. В случае параллельного расположения перекрывающихся p АО образуется π – связь:
- 9. Номенклатура алкенов Неразветвленную цепь нумеруют с того конца, ближе к которому находится двойная связь. Суффикс –ан
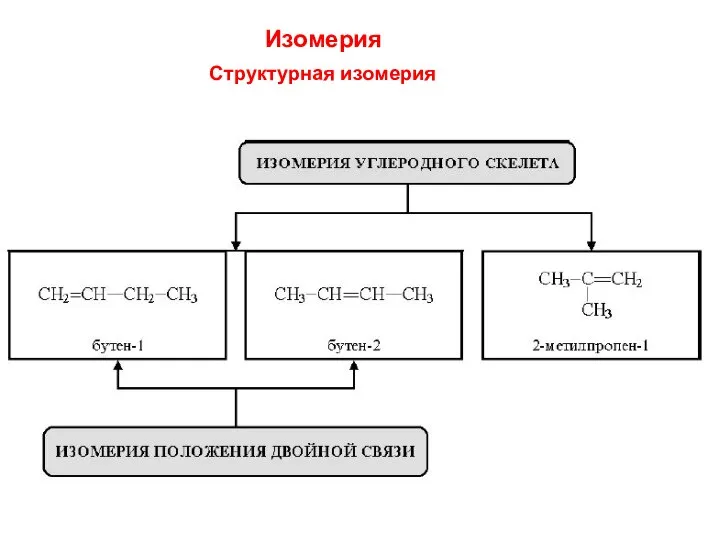
- 10. Изомерия Структурная изомерия
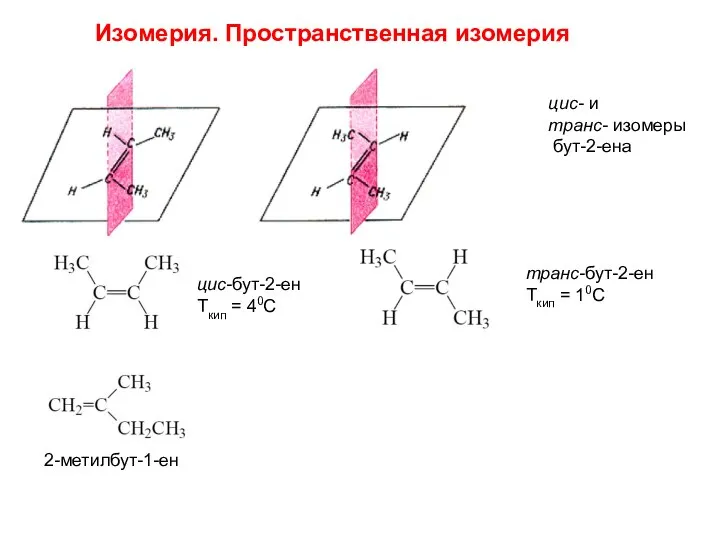
- 11. цис- и транс- изомеры бут-2-ена цис-бут-2-ен Ткип = 40С транс-бут-2-ен Ткип = 10С 2-метилбут-1-ен Изомерия. Пространственная
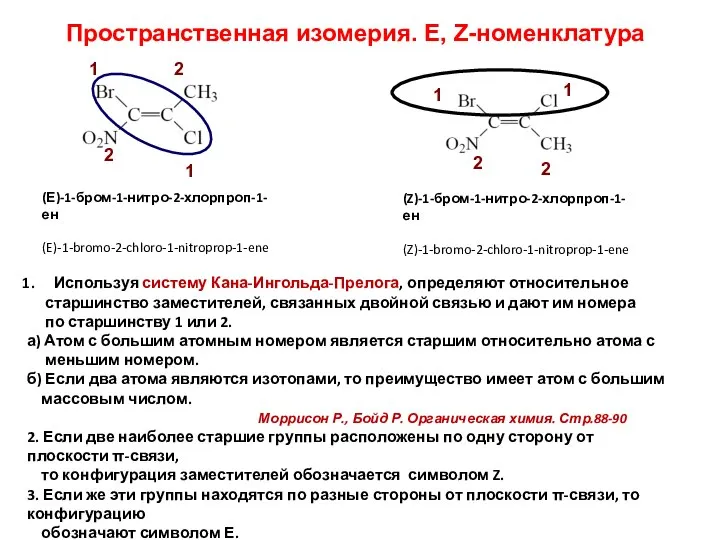
- 12. Пространственная изомерия. E, Z-номенклатура Используя систему Кана-Ингольда-Прелога, определяют относительное старшинство заместителей, связанных двойной связью и дают
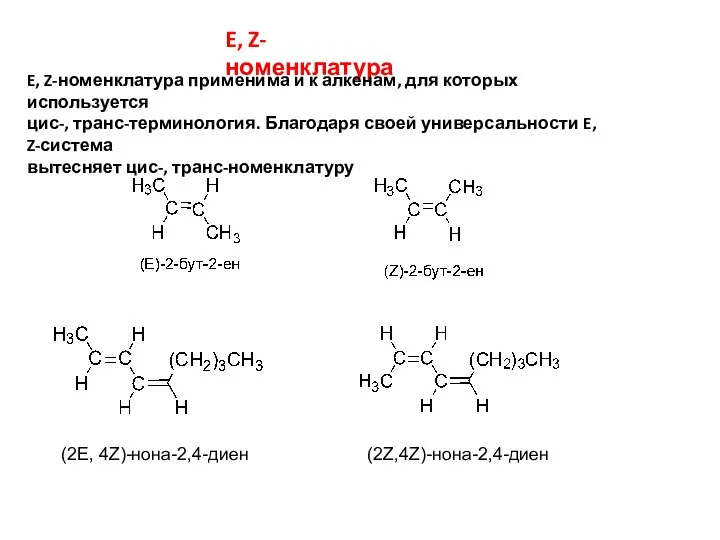
- 13. E, Z-номенклатура E, Z-номенклатура применима и к алкенам, для которых используется цис-, транс-терминология. Благодаря своей универсальности
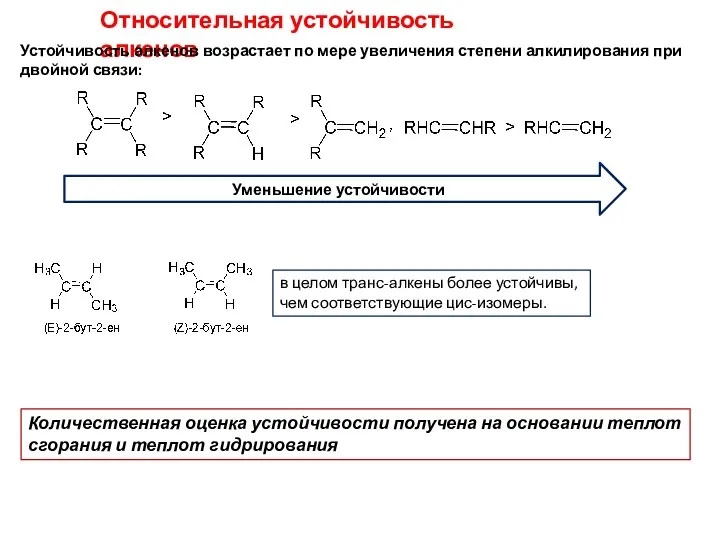
- 14. Относительная устойчивость алкенов Устойчивость алкенов возрастает по мере увеличения степени алкилирования при двойной связи: Количественная оценка
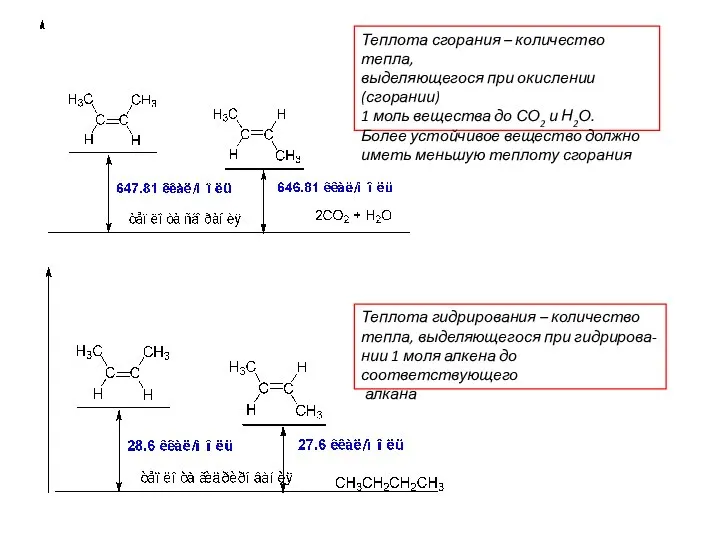
- 15. Теплота сгорания – количество тепла, выделяющегося при окислении (сгорании) 1 моль вещества до СО2 и Н2О.
- 16. Физические свойства алкенов По физическим свойствам этиленовые углеводороды близки к алканам. При нормальных условиях углеводороды C2–C4
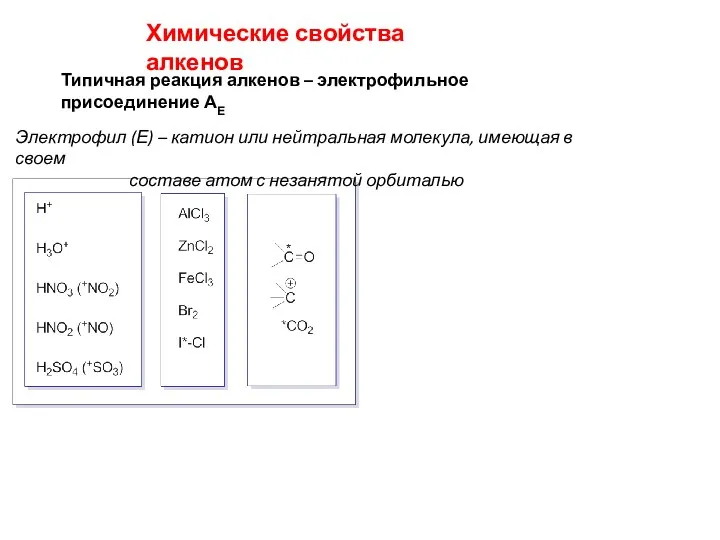
- 17. Химические свойства алкенов Типичная реакция алкенов – электрофильное присоединение АЕ Электрофил (Е) – катион или нейтральная
- 19. Скачать презентацию




 Кремний и его соединения. Силикатная промышленность
Кремний и его соединения. Силикатная промышленность Водород
Водород Презентация Повторение к СОЧ-10 кл (1)
Презентация Повторение к СОЧ-10 кл (1) Основные особенности процессов растворения твёрдых веществ
Основные особенности процессов растворения твёрдых веществ Титриметрический анализ. Основные понятия
Титриметрический анализ. Основные понятия Исследование структуры продуктов аммонолиза мезопористых магниетермических порошков тантала
Исследование структуры продуктов аммонолиза мезопористых магниетермических порошков тантала Кислород
Кислород Алкены-2 (электрофильные реакции)
Алкены-2 (электрофильные реакции) Образование и получение веществ. 6 класс
Образование и получение веществ. 6 класс Презентация по Химии "Соединения алюминия"
Презентация по Химии "Соединения алюминия"  Металл алюминий
Металл алюминий Презентация на тему Основные классы неорганических соединений
Презентация на тему Основные классы неорганических соединений  Химия в быту
Химия в быту Презентация на тему Факторы, влияющие на скорость химической реакции
Презентация на тему Факторы, влияющие на скорость химической реакции  Термохимические эффекты реакций
Термохимические эффекты реакций Проверочный тест. Номенклатура алканов
Проверочный тест. Номенклатура алканов Химическое равновесие
Химическое равновесие Аминокислоты
Аминокислоты Скорость химической реакции. Химическое равновесие
Скорость химической реакции. Химическое равновесие Материаловедение. Легированные стали и сплавы. (Тема 11)
Материаловедение. Легированные стали и сплавы. (Тема 11) АРЕНЫ
АРЕНЫ Дисахариды и полисахариды
Дисахариды и полисахариды Радиоактивность. Тест
Радиоактивность. Тест Презентация на тему Производство аммиака
Презентация на тему Производство аммиака  Характеристика галогенов
Характеристика галогенов Электрические явления на поверхности раздела фаз. Лекция 8
Электрические явления на поверхности раздела фаз. Лекция 8 Фуллерены (шары Бакминстера)
Фуллерены (шары Бакминстера) Физические свойства воды.Перегонка. Растворимость веществ в воде
Физические свойства воды.Перегонка. Растворимость веществ в воде