Слайд 2Физические и химические свойства алкенов
Физические свойства алкенов аналогичны
свойствам алканов.
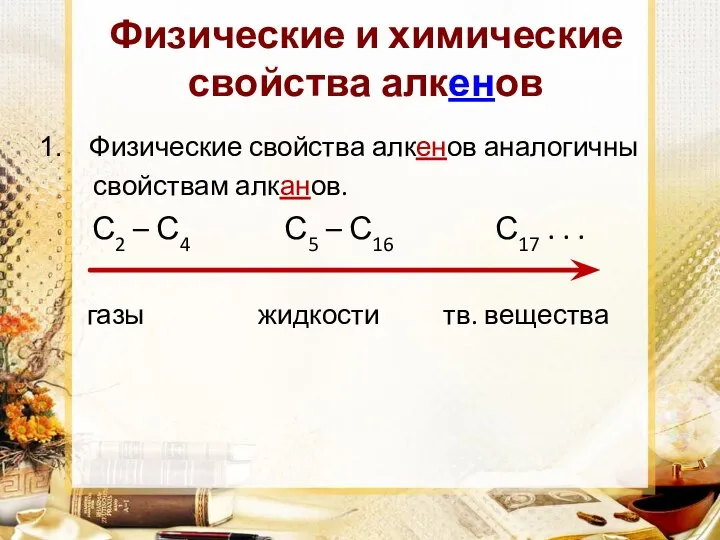
С2 – С4 С5 – С16 С17 . . .
газы жидкости тв. вещества
Слайд 4Реакция гидрирования.
Эту реакцию можно рассматривать как реакцию восстановления.
Реакция происходит только в присутствии

катализатора: Pt, Pd, Ni.
CH2 = CH – CH3 + H2 → CH3 – CH2 – CH3
алкен алкан
Слайд 5Реакция галогенирования.
Присоединение Br2 к алкенам является качественной реакцией на непредельные УВ.

(Br2 – жёлтого цвета, при пропускании его через алкен, раствор обесцвечивается).
СH2 = CH – CH3 + Br2 → CH2 – CH – CH3
I I
Br Br
Слайд 6Реакция гидрогалогенирования.
Правило Марковникова:
- при присоединении к алкенам молекул типа H-X,

водород присоединяется к углероду с наибольшим количеством атомов водорода при двойной связи.
СH2 = CH – CH3 + HBr → CH3 – CH – CH3
I
Br
Слайд 7Реакция гидратации.
Происходит по правилу Марковникова.
Происходит присутствии катализатора:
H2SO4, HNO3,

HClO4.
Н+
СH2 = CH – CH3 + H2O → CH3 – CH – CH3
(HOH) I
OH
Слайд 8Реакция горения.
Происходит с полным разрушением углеродной цепи.
СH2 = CH2 + 3O2

→ 2СO2 + 2H2O
Слайд 9Реакция мягкого окисления
(реакция Вагнера).
В качестве окислителя используется KMnO4 (3%). Щелочная среда.

Эта реакция является качественной на двойную связь.
Учебник, стр. 40.
ОН-
СH2 = CH2 + H2O + KMnO4 → CH2 – CH2
I I
OH OH
Слайд 10Реакция глубокого окисления.
В качестве окислителя используется KMnO4,
HNO3, K2Cr2O7
O
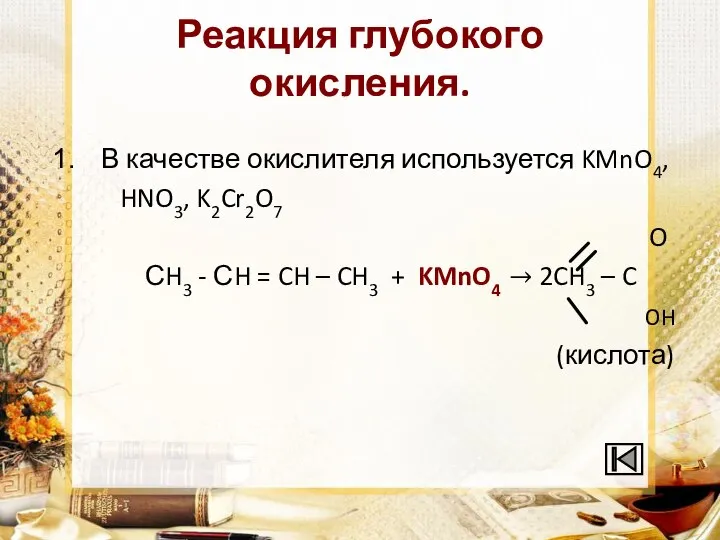
СH3 - СH = CH – CH3 + KMnO4 → 2CH3 – C
OH
(кислота)









 Решение задач
Решение задач ГАЛОГЕНЫ
ГАЛОГЕНЫ Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат
Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат Металлы. Общая характеристика, химические свойства. Получение
Металлы. Общая характеристика, химические свойства. Получение Углеводы. Дисахариды. Полисахариды. Лекция 6
Углеводы. Дисахариды. Полисахариды. Лекция 6 Классификация_органических_соединений[1]
Классификация_органических_соединений[1] Титриметрический анализ
Титриметрический анализ Химическая связь
Химическая связь Потенциометрические анализаторы Поверка рН - метра
Потенциометрические анализаторы Поверка рН - метра Липиды. Источники
Липиды. Источники Кроссворд. Плотность
Кроссворд. Плотность Кислотность почв с.Берёзовка МОУ «СОШ с.Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс
Кислотность почв с.Берёзовка МОУ «СОШ с.Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс Композитный материал
Композитный материал Учебно-познавательные задачи на уроках химии
Учебно-познавательные задачи на уроках химии Предмет химии. Вещества
Предмет химии. Вещества Ароматические полиамиды (арамиды)
Ароматические полиамиды (арамиды) Структура материалов
Структура материалов Вуглеводи. Групи
Вуглеводи. Групи Основные понятия и законы химии
Основные понятия и законы химии Классификация НПВС (по химической структуре активности)
Классификация НПВС (по химической структуре активности) Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Композиційні матеріали на основі функціоналізованих олігодієнів, вінілових мономерів і наповнювачів різної природи
Композиційні матеріали на основі функціоналізованих олігодієнів, вінілових мономерів і наповнювачів різної природи Презентация на тему Викторина по химии "Что это?"
Презентация на тему Викторина по химии "Что это?" 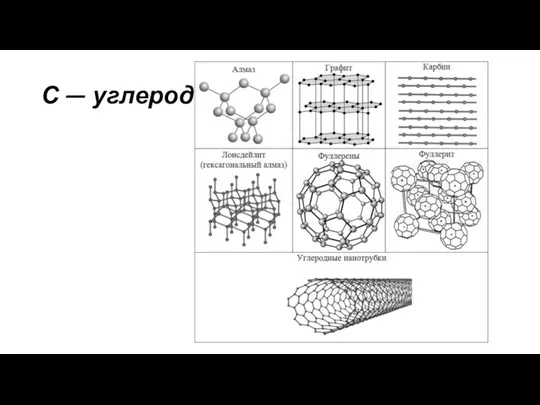 С - углерод. Применение
С - углерод. Применение Валентность и ковалентность химической связи
Валентность и ковалентность химической связи Общая характеристика элементов подгруппы углерода. Углерод – его строение и свойства
Общая характеристика элементов подгруппы углерода. Углерод – его строение и свойства Презентация на тему Дисперсные системы
Презентация на тему Дисперсные системы  Сравнительная характеристика бензольного кольца и олимпийских колец
Сравнительная характеристика бензольного кольца и олимпийских колец