Слайд 2План:
Общая характеристика металлов.
Нахождение в природе.
Способы получения металлов.
Химические свойства металлов.
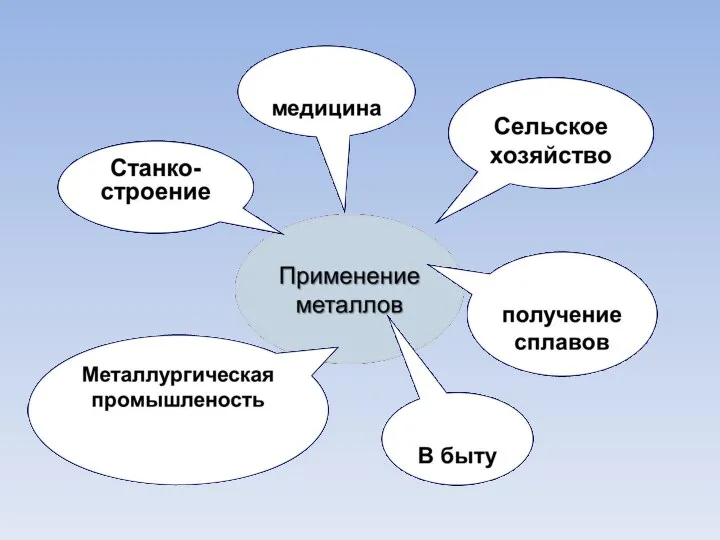
Применение металлов.

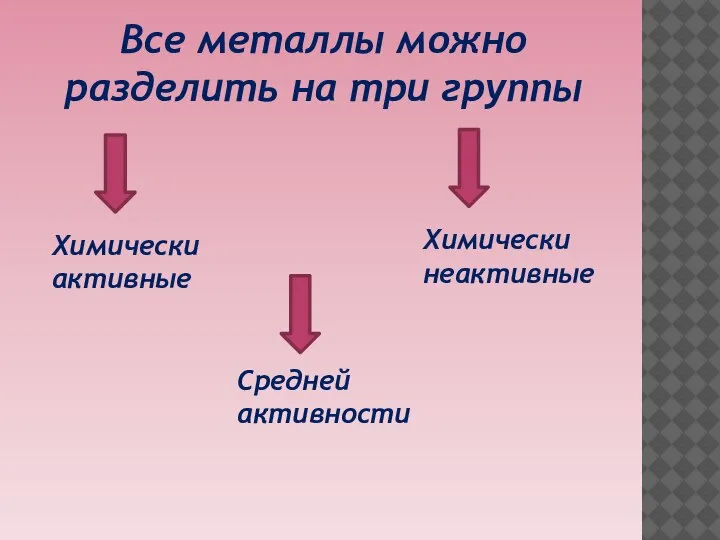
Слайд 3Все металлы можно разделить на три группы
Химически активные
Средней
активности
Химически
неактивные
Слайд 4LiKBaCaNaMg
AlMnZnCrFeCoNiSnPb
H2
CuAgHgAu
Химически активные металлы
Химически неактивные металлы
Металлы средней активности
РЯД АКТИВНОСТИ МЕТАЛЛОВ

Слайд 5ХИМИЧЕСКИ АКТИВНЫЕ МЕТАЛЛЫ ( ДО AL )
Химически активные металлы в природе

встречаются только в виде солей:
Хлоридов NaCL; KCL
Сульфатов Na2SO4 ∙10 H2O, CaSO4 ∙2H2O
Нитратов NaNO3; KNO3
Карбонатов CaCO3 ; MgCO3
Слайд 6МЕТАЛЛЫ СРЕДНЕЙ АКТИВНОСТИ(ОТ AL ДО PВ)
Металлы средней активности в природе встречаются в

виде оксидов и сульфидов:
Fe3O4
Fe2O3* nH2O
SnO2
ZnS
PbS
…
Слайд 7 ХИМИЧЕСКИ НЕАКТИВНЫЕ И БЛАГОРОДНЫЕ МЕТАЛЛЫ
Благородные металлы встречаются как в свободном виде,

так и в виде солей:
Ag2S; AgCL; PtS…
Pt
Ag
Au
Слайд 8Способы получения металлов
Восстановление углеродом
МеО + С → Ме + СО↑
2. Электролиз
CuSO4 →
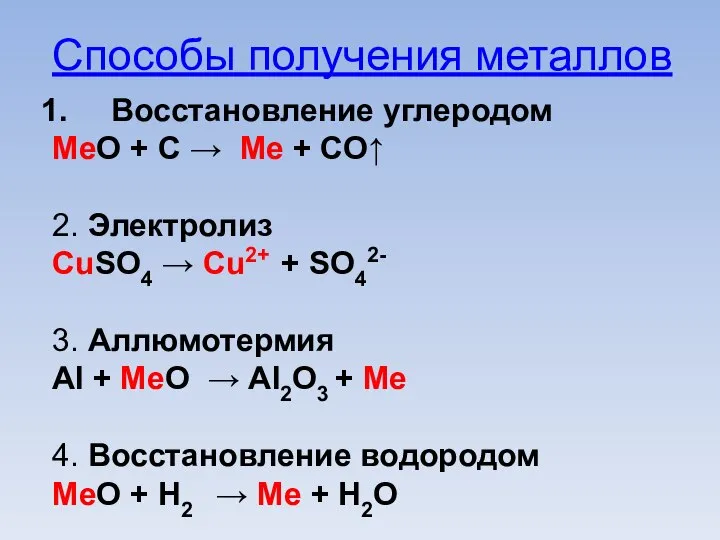
Cu2+ + SO42-
3. Аллюмотермия
Al + МеО → Аl2O3 + Ме
4. Восстановление водородом
MeO + Н2 → Ме + Н2О
Слайд 9Химические свойства металлов
Взаимодействие с простыми веществами цинка, меди, хрома, железа.
О2

→ МеО оксид
Ме + Cl2→ МеCl2 хлорид
S → МеS сульфид
Слайд 10Взаимодействие со сложными веществами меди.
а) взаимодействие с разбавленными кислотами и
щелочами
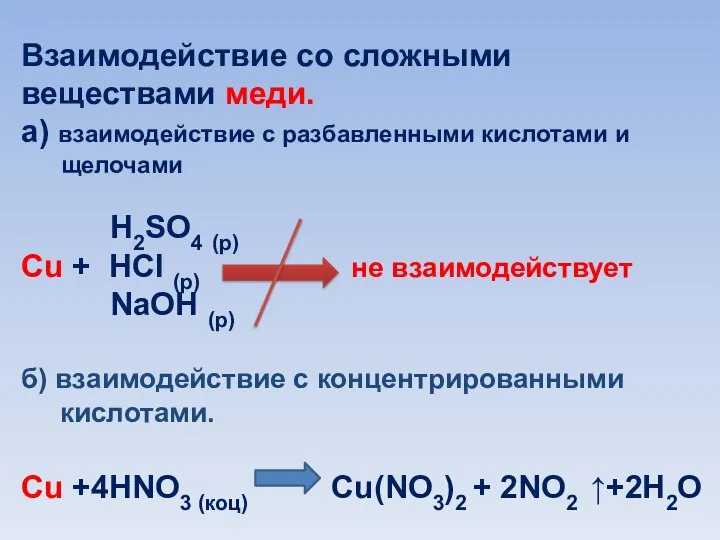
H2SO4 (р)
Cu + HCl (р) не взаимодействует
NaOH (р)
б) взаимодействие с концентрированными
кислотами.
Cu +4HNO3 (коц) Cu(NO3)2 + 2NO2 ↑+2H2O
Слайд 11Взаимодействие со сложными веществами цинка, хрома, железа.
а) взаимодействие с разбавленными
кислотами.
Zn
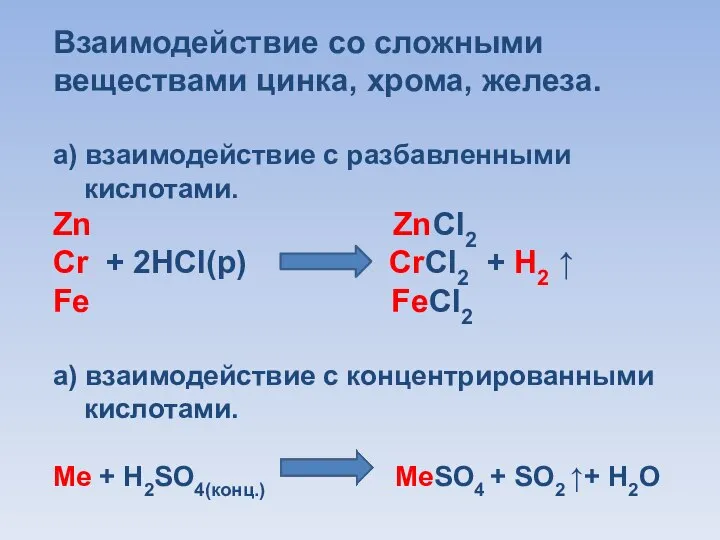
ZnCl2
Cr + 2HCl(р) CrCl2 + H2 ↑
Fe FeCl2
а) взаимодействие с концентрированными
кислотами.
Ме + Н2SO4(конц.) МеSO4 + SO2 ↑+ H2O
Слайд 13Ответьте на вопросы по пройденной
теме в рабочей тетради

Слайд 141. В природе металлы находятся преимущественно:
а) в свободном состоянии
б) в виде соединений
2.

Природные соединения, из которых технологически возможно и экономически целесообразно добывать металлы, называют:
А) минералами
Б) породой
В) рудами
Г) соединениями
Слайд 153. Чтобы получить металл из оксидных руд, их:
А) разлагают
Б) обжигают
В) окисляют
Г) восстанавливают
4.

Для металлов характерен тип химической связи:
A) Металлическая
Б) Ионная
В) Ковалентная неполярная
Г) Водородная
Слайд 16
5. Какую степень окисления в соединениях проявляет цинк?
6. Где применяется хром?

7. Перечислите сплавы которые получают из железа?
8. Как называют сплав меди с оловом?














 Предельные углеводороды
Предельные углеводороды Решение задач по органической химии
Решение задач по органической химии Получение и применение кислорода. Круговорот кислорода в природе
Получение и применение кислорода. Круговорот кислорода в природе Физические свойства полупроводников
Физические свойства полупроводников Презентация на тему Органическая химия "Жиры"
Презентация на тему Органическая химия "Жиры"  Кислород как вещество
Кислород как вещество Удосконалення процесів знешкодження рідких відходів виробництв оцтової кислоти потужністю 150 тис. т/рік
Удосконалення процесів знешкодження рідких відходів виробництв оцтової кислоти потужністю 150 тис. т/рік Презентация на тему Оксиды. Основания. Кислоты
Презентация на тему Оксиды. Основания. Кислоты  Алкены. Роль алкенов в жизни человека
Алкены. Роль алкенов в жизни человека Соединения галогенов
Соединения галогенов Химический анализ
Химический анализ Влияние эллементов на состав растений. Содержание тяжелого металла в растениях. Нитраты в растениях
Влияние эллементов на состав растений. Содержание тяжелого металла в растениях. Нитраты в растениях Гетероциклические соединения. Пятичленные гетероциклы с одним гетероатомом
Гетероциклические соединения. Пятичленные гетероциклы с одним гетероатомом Аттестационная работа. Сколько наша семья потребляет энергоресурсов и выбрасывает углекислого газа
Аттестационная работа. Сколько наша семья потребляет энергоресурсов и выбрасывает углекислого газа Веселый химический КВН
Веселый химический КВН Синтез ацетилена из природного газа в производстве ацетилена
Синтез ацетилена из природного газа в производстве ацетилена Соединения щелочноземельных металлов
Соединения щелочноземельных металлов Кислород. Применение и круговорот в природе. 8 класс
Кислород. Применение и круговорот в природе. 8 класс Презентация по Химии "Токсическое действие неорганических веществ"
Презентация по Химии "Токсическое действие неорганических веществ"  Химия углеводов
Химия углеводов Строение атома
Строение атома Вода. Строение молекулы воды. Анализ и синтез воды
Вода. Строение молекулы воды. Анализ и синтез воды Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Практико-ориентированные задачи по химии для студентов гуманитарных специальностей
Практико-ориентированные задачи по химии для студентов гуманитарных специальностей Коррозия металлов (9 класс)
Коррозия металлов (9 класс) Углеводы. Классификация
Углеводы. Классификация Фторопласты и их использование
Фторопласты и их использование lektsia_7
lektsia_7