Слайд 2Физико-химические основы процессов восстановления
Восстановление оксидов
2Ме + О2 = 2МеО (1)
2Х +

О2 = 2ХО (2)
|ΔG2| > |ΔG1|
MeО +Х → Me + ХО
ΔG<0
W, Fe, Мo, Cr ,Nb, Мn, Si, Ti, Zr, Mg, Al, Ca
Слайд 3Восстановление оксидов
1. Восстановление металлами (Mg, Al, Ca)
2. Восстановление углеродом
3. Восстановление водородом

Слайд 4Зависимость ΔG реакции восстановления оксидов от температуры
МеО + С = Ме +

СО
Слайд 5Преимущества способа восстановления
Низкая стоимость процессов восстановления углеродом;
Хорошая контролируемость размеров частиц (оксиды обычно

хрупки, легко измельчаются и просеиваются);
Получение пористых частиц, которые легко прессуются;
Возможность применения как для мелкого так и крупного производства, в непрерывном или периодическом режиме;
Слайд 6Недостатки способа восстановления
Высокая стоимость восстановления чистыми газами;
В некоторых случаях большая потребность в

газе – восстановителе при ограниченных масштабах его производства;
Чистота конечного продукта обычно полностью зависит от чистоты сырья;
За некоторыми исключениями процессы восстановления непригодны для производства порошков сплавов;
Слайд 7Восстановление галогенидов
MeClx + х/2 H2 → Me + x HCl
Исходное сырье:

хлориды и фториды железа, вольфрама, молибдена, ниобия, тантала, титана, циркония
Слайд 8Типы восстановителей
- газообразные (Н2, СО и газы, содержащие СО и Н2 -

генераторный, природный конвертированный, водяной, коксовый, доменный газ, диссоциированный аммиак);
- твердый - углерод в виде сажи, антрацит;
- жидкие - металлы (натрий, кальций, магний) или их соединения, например гидрид кальция и др.;
- комбинированный - твердый и газообразный одновременно
Слайд 9Получение порошка железа
оксидное сырье
1. Прокатная окалина. Окалина состоит из Fe3О4, и Fe203

с общим содержанием железа около 72 %.
2. Высокообогащенный концентрат природных окисленных железных руд с содержанием железа около 71% в виде гематита (Fe203) и магнетита (Fe3О4)
Слайд 10Процессы восстановления оксидов железа
3Fe2O3 + Н2 = 2 Fe3О4 + H20

+ 7,14 кДж
Fe3О4 + Н2 = 3FeO+ H20 - 53,00 кДж
FeO + Н2 = Fe +H20 -30,24 кДж
Fe3О4 + Н2 = 3Fe +4H20 - 224, кДж .
Слайд 11механизм восстановления оксидов металлов газообразным восстановителем
1. Адсорбция газа-восстановителя (Н2, СО) на

поверхности оксида.
2. Уход электронов от атомов адсорбированного восстановителя в решетку оксида, например FeO, с образованием положительных ионов восстановителя:
Н2 -2ё = 2Н+
3. Взаимодействие катиона восстановителя с анионом кислорода на поверхности кристалла оксида в наиболее энергетически выгодных (дефектных) местах с образованием Н2О (или С02).
4. Десорбция образующихся молекул Н2О (или С02).
5. Образование ионов металла при уходе кислорода с поверхности оксида.
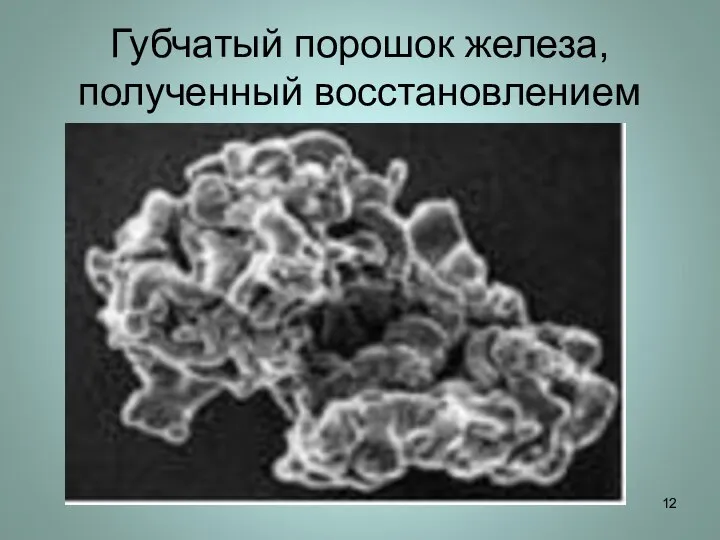
Слайд 12Губчатый порошок железа, полученный восстановлением
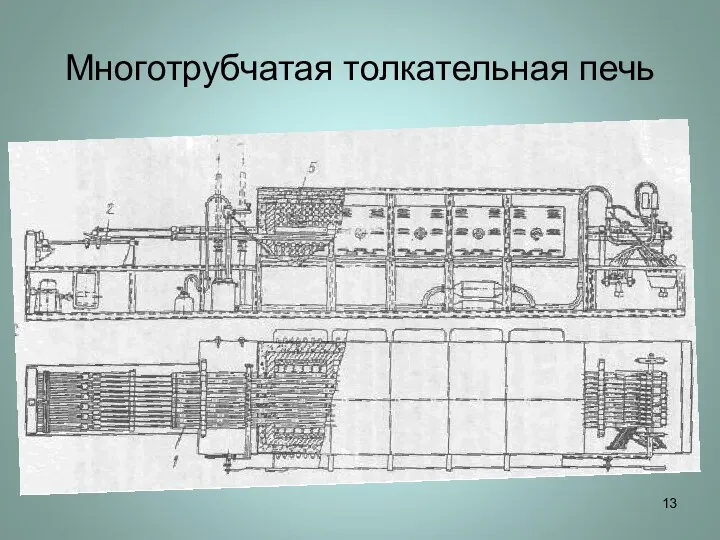
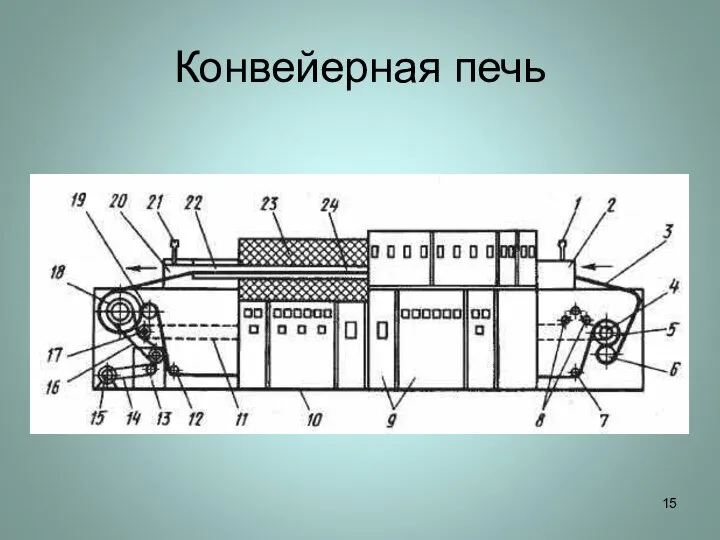
Слайд 13Многотрубчатая толкательная печь
Слайд 16Схема получения порошка железа в установке кипящего слоя
1 - вращающаяся печь для
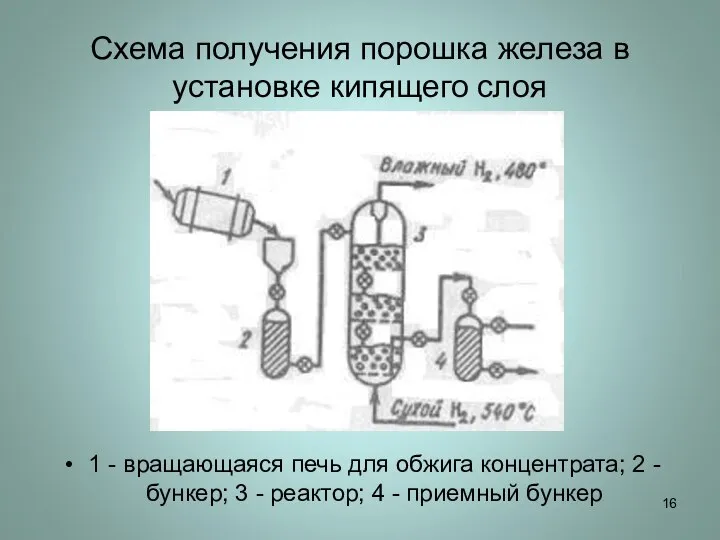
обжига концентрата; 2 - бункер; 3 - реактор; 4 - приемный бункер
Слайд 17Варианты получения железного порошка восстановлением водородом
I. В проходных муфельных или трубчатых

печах; t1= 650 ÷ 700 °C, t2 = 700 ÷ 800 °C
2. В конвейерной проходной печи; t = 980 °C, τ = 5 час.
3. В печи кипящего слоя. t = 540 °C + отжиг 800 °C.
Слайд 18MeO + C0 = Me+ C02
C + C02 = 2 CO
_________________________
MeO +
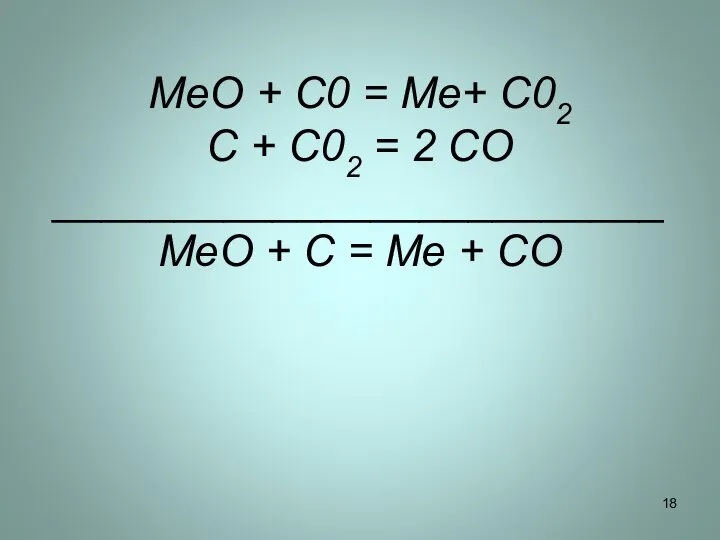
C = Me + CO
Слайд 19Процессы восстановления оксидов железа твердым углеродом
3 Fe2O3+ C = 2 Fe3О4

+ СО
6 Fe2O3+ C = 4 Fe3О4 + СО2
Fe3О4 + C = 3FeO + СО
2Fe3О4 + C = 6FeO + СО2
FeO+C = Fe+CO
2FeO+C = 2Fe+CO2
Fe3О4 + 4C = 3Fe + 4СО
Fe3О4 + 2C = 3Fe + 2СО2
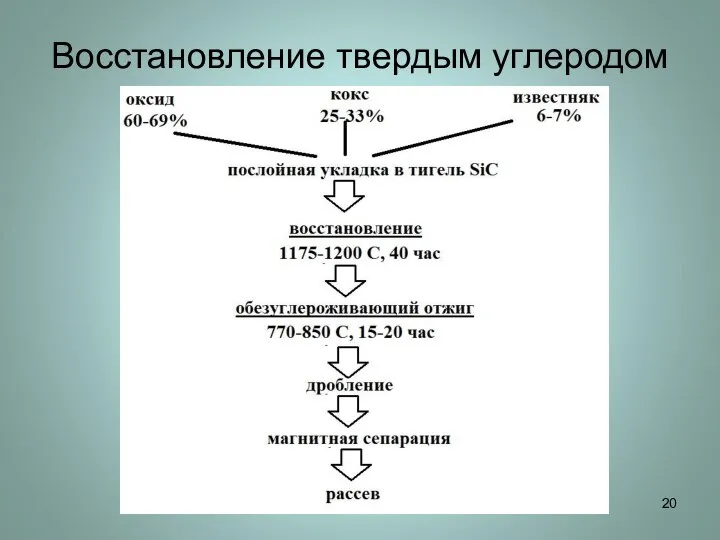
Слайд 20Восстановление твердым углеродом
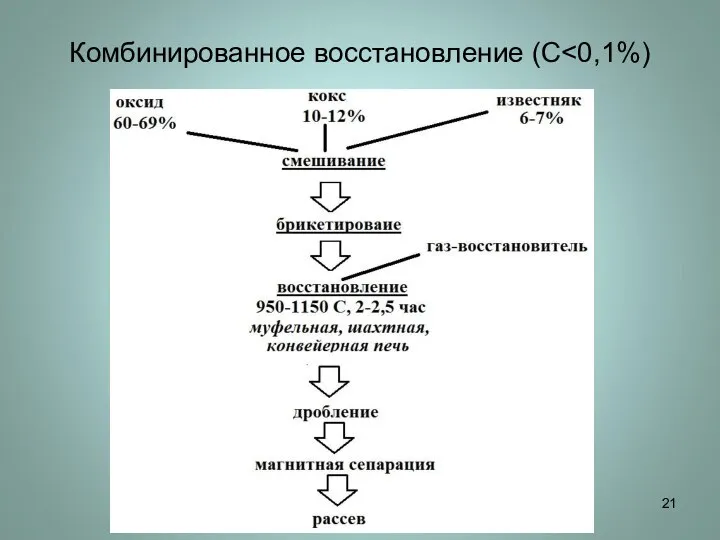
Слайд 21Комбинированное восстановление (С<0,1%)
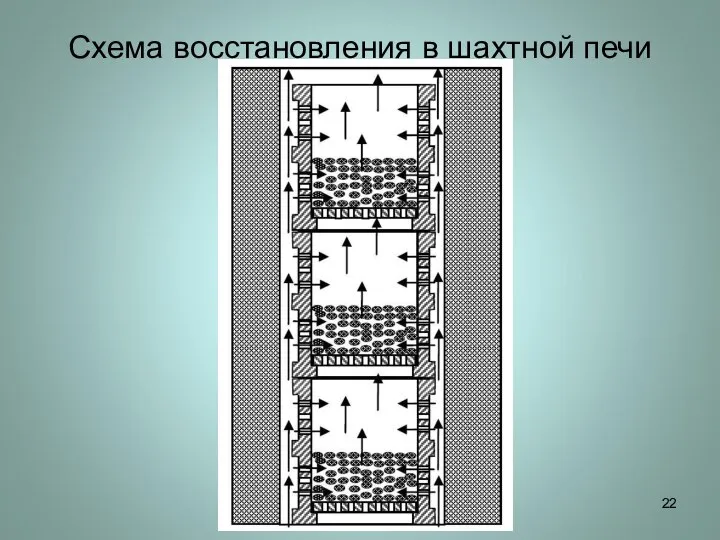
Слайд 22Схема восстановления в шахтной печи
Слайд 23Классификация железных порошков
ГОСТ 9849-86

Слайд 24Химический состав железного порошка
Регламентируется содержание элементов: C, Si, Mn, S, P, потери
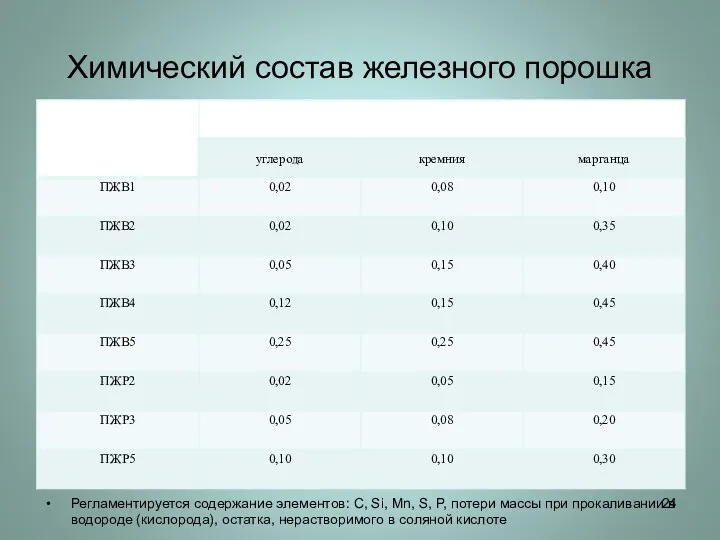
массы при прокаливании в водороде (кислорода), остатка, нерастворимого в соляной кислоте
Слайд 25Гранулометрический состав порошка
Знак «-» означает, что контроль данных фракций не проводится. Наличие

следов данных фракций не является браковочным признаком.















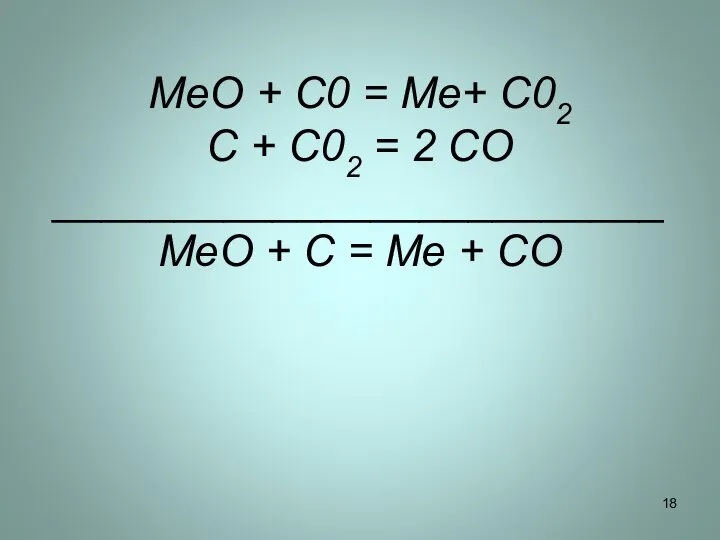








 Химическая связь
Химическая связь Дополнительный_материал_11.15_23.09.2022_e4f87550
Дополнительный_материал_11.15_23.09.2022_e4f87550 Белки. Химия
Белки. Химия Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок
Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок Классы неорганических соединений
Классы неорганических соединений Промышленный метод получения ацетилена
Промышленный метод получения ацетилена Оксиды и гидрооксиды
Оксиды и гидрооксиды Водород
Водород валентность (1)
валентность (1) Идеальный газ
Идеальный газ Азот, соединения азота
Азот, соединения азота кристаллические решетки (2) (2)
кристаллические решетки (2) (2) Презентация на тему Электролиз
Презентация на тему Электролиз  Алканы: состав, строение, изомерия, номенклатура, получение
Алканы: состав, строение, изомерия, номенклатура, получение Презентация на тему Неогранические соединения. Периодическая таблица
Презентация на тему Неогранические соединения. Периодическая таблица  Коррозия металлов. Экзаменационные вопросы
Коррозия металлов. Экзаменационные вопросы Температурная зависимость скорости химической реакции
Температурная зависимость скорости химической реакции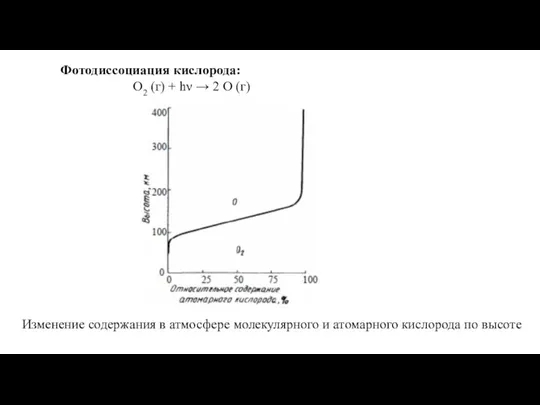 Фотодиссоциация кислорода
Фотодиссоциация кислорода Основы теории сплавов. Типы сплавов (твердые растворы, сплавы-смеси, сплавы- химические соединения. Диаграммы
Основы теории сплавов. Типы сплавов (твердые растворы, сплавы-смеси, сплавы- химические соединения. Диаграммы Особенности решения практикоориентированного задания №26 ГИА-11
Особенности решения практикоориентированного задания №26 ГИА-11 Звездный час. Конкурс химиков
Звездный час. Конкурс химиков Щелочные металлы
Щелочные металлы Плотность вещества
Плотность вещества Молекулярная химия
Молекулярная химия Башня плотности
Башня плотности Химия в нашем доме. Введение в курс. Урок №1
Химия в нашем доме. Введение в курс. Урок №1 Галогены
Галогены Нітрогеновмісні сполуки
Нітрогеновмісні сполуки