Слайд 2ЖОСПАР
І КІРІСПЕ
ІІ НЕГІЗГІ БӨЛІМ
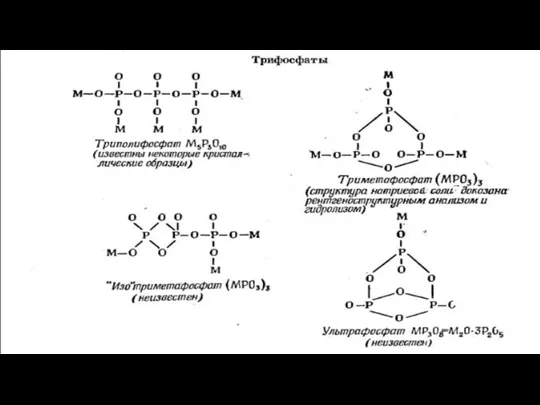
ФОСФАТТАРДАҒЫ БАЙЛАНЫС ЕРЕКШЕЛІКТЕРІ
Р-О-Р БАЙЛАНЫСЫНДАҒЫ

КЕРНЕУЛІК
ТІЗБЕКТІ ФОСФАТТАР ҮШІН ФОРМУЛА
САҚИНАЛЫ ФОСФАТТАР ҮШІН ФОРМУЛА
ФОСФАТТАРҒА ЖАЛПЫ ФОРМУЛА
ІІІ ҚОРЫТЫНДЫ
Слайд 3КІРІСПЕ
Фосфаттарда байланыстың ковалентті және иондық түрлері таралған. Оларда басқа фосфорлы қосылыстардағыдай фосфор

басқа атомдармен sp2 (координациялық саны 4-ке тең, тетраэдр құрылымды). Яғни, бұл бойынша фосфаттар деп аниондарда әр фосфор атомы тетраэр төрт бұрышындағы 4 оттек атомымен байланысқан қосылыстарды айтады. Жеке РО4 тетраэдрлерінің оттек атомдарымен байланысынан тізбекті, тармақталған және сақиналы полимерлер түзіледі. Яғни, фосфат түзуші бірнеше ғана құрылымдық бөліктер болады. Олардың бірі – РО4, мұнда 3 оттек атомы көрші РО4 атомына да ортақ болады. Оны тармақталу нүктесі дейді. Бұдан басқа 2 О атомы басқа РО4 атомдарына ортақ, бір теріс заряды не эфирлік байланысы бар РО4 орта тобы және 1 ортақ О атомы мен екі теріс заряды не эфирлік байланыстар бар РО4 соңғы тобы бар. Сонымен бірге 3 теріс зарядты 1 РО4 топты құрылым да кездеседі (моно- не ортофосфат).
Слайд 4Фосфаттарда Р-О-Р және М-О-Р байланыстар таралған. РО4 тобынан үш байланыс (ионды не

ковалентті) пен әр М атомы бір байланысқа ие болатындықтан, байланыс саны мынадай:
N бүтін сан болу керек, қарапйаым құрылым түзілу үшін ол екі еселенеді. 1 Р, 2 М атомы бар фосфаттар кездеспейді, бірақ 2 Р, 4 М атомды фосфаттың бар екендігі белгілі (R=M/P=
=4/2). Бар жай фосфат құрылымы ондағы Р атомы саны R саны жұп болғанда түзіледі. Егер ол тақ болғанда, онда қарапайым құрылым алу үшін ол екі еселенеді. Бұны 1-теңдеуді 2N = M+3P келтіргенде есептейді, мұндағы М+3Р – жұп сан. Тақ санды үш еселе-генде тақ, 4 еселегенде жұп сан болатындықтан, құрылымдағы Р атомы саны қатынас саны-на тең болуы үшін R жұп сан болуы шарт. Ескеретін жайт, R=1/1 қатынасында ереже есеп-телмейді. R=1 болғанда жай фосфат құрылымын РО4 тобынан алу мүмкін емес, ол
тобынан түзіледі. Мұнда Р-О екі байланысы жарты байланыс сияқты болады. Мұнадй қосылысқа сай ең қарапайым құрылым -
Слайд 5Фосфаттағы әр катионда не органикалық радикалда бір жарты байланыс бар, яғни 2-теңдеу

бойынша әр катионнан бір жарты байланысты алса, Р-О-Р байланыс саны Nр болады:
О атомының саны:
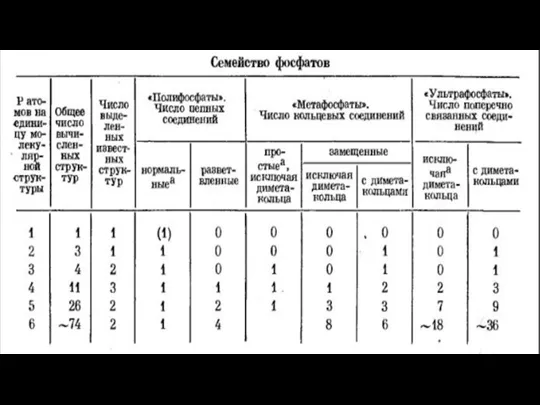
Соңғы теңдеулерді қолданып R санына сәйкес фосфатты құрылымдағы мүмкін болатын атомның ең төменгі сандарын есептеуге болады. Кейбір R сандарына сай фосфат құрылым-дары белгісіз, мысалы, R=7/3 үшін. Берілген R саны үшін фосфат құрылымының бар болу мүмкіндігін анықтау үшін төмендегі теңсіздік қолданылады:
Егер Р N+1-ден үлкен болса, R саны шамамен екі фосфат құрылымына сәйкес. (R=3 басқа). Егер R<3 болса, Р және Np үшін бірнеше құрылымдардың қосындысы сәйкес. Теңсіздік қоспаның бар екендігін білдіреді.
Слайд 11Р-О-Р БАЙЛАНЫСЫНДАҒЫ КЕРНЕУЛІК
Молекулярлы фосфат иондарында диметилфосфат сақинасының пайда болу мүмкіндігі және кездейсоқ

молекула түзілу жайлы сұрақ өте қызықты. Ең үлкен валентті бұрыштар жазық сақиналарда алынған. Мұндай жағдайда төрт валентті бұрыштар 360˚-қа дейін үлкейе алады,яғни фосфор атомының sp3 гибридизациясы қарапайым оттегі гибридизациясынан (p2 және sp) кішірек.
Сонымен қатар екі бұрыштың жалпы суммасы ең минимальды өлшемге ие 90˚ гибридизация отттегінікі,және sp3 гибридизациялы фосфорлы екі бұрышы 109˚28 градустан 398˚56 градусқа ие,сондықтан сақинадағы бұрыштық қуат бұл жағдайда 39˚ аспауы керек . Бірақ , егер P-O-P бұрышы О-Р-О бұрышы 100˚ тең болса , бұрыштардың жалпы суммасы жазық бұрыштан 100˚градусқа үлкен болу керек . Жалпы энергиялары сәйкес келетін экспериментальды нәтиже көрсеткендей циклопрапан, циклобутан,этилен және Р4 молекулаларындағы жылудан диметафосфат сақинасын түзетін фосфат жылулары тек бірнеше килограммколорий мольге ғана айырмашылық болуы керек.
Диметафосфат сақиналарына қосымша ретінде , олардың көрші тетраэдрлері екі ортақ бұрышқа сәйкес,қосымша тағы бір жағдай көрші тетраэдрлері үш ортақ бұрышқа сәйкес бола береді. Тек бір ғана қосылыс – дифосфат қана осы кұрылымға ие; ол Р2О5 мономері болып табылады . Р2О5 мономерлеріндегі кұрылыс О-Р-О бұрышы үшін 2α, ал Р-О-Р бұрышы үшін 2β болып табылады, Сонда теңдік мынадай түрде болады:
Sinα=cos 30˚cos β
Слайд 12ТІЗБЕКТІ ФОСФАТТАР ҮШІН ФОРМУЛА
Тізбекті фосфаттарда Р-О-Р байланысқа қарағанда Р атомының саны бірге

артық, яғни Np =P-1, з теңдеудегі Np cанын Р - 1 арқылы алмастырсақ:
немесе
5-теңдеуден
Р атомының саны n-ге тең болса, фосфаттың жалпы формуласы мынадай болады:
Соңғы формула тікелей және тармақталған тізбекті ұқсас фосфаттарға арналған. n=0 болса формула бұрыс, n=1 болса, ортофосфаттың формуласы шығады, n=2 болса, пирофосфаттікі, n=3 болса үшполифосфаттікі шығады.
Тізбекті фосфаттардың жалпы формуласын мына түрде жазу ыңғайлы:
Тізбекті фосфаттар үшін
Слайд 13
САҚИНАЛЫ ФОСФАТТАР ҮШІН ФОРМУЛА
Жай фосфаттардың атом саны Р-О-Р байланысындағыдай болады, бұл жағдай

егер кейбір өлшемі белгілі қарапайым тармақталған тізбектер сақинаға қосылса және тізбектердің бір –бірімен байланысы конденсирленген сақина түзгенше . Бұл жағдайда Np=P, және бұл өлшемді 3- теңдікке , одан соң 5-теңдікке қойсақ тізбекті қосылыстарда бұл сақиналы фосфаттың MnPnO3nформуласын береді, мұндай құрылымдарда метафосфаттың мәні
Егер метафосфат формуласын қос тотық ретінде қарастырсақ , онда ол nM2O*nP2O5түрінде болады . Орташа топтарда бір М атомына бір Р атомы келеді, онда бүтіндей орташа топтардан тұратын құрылым метафосфат құрылымына сәйкес. Сонымен қатар , егер бір мезгілде тармақталған нүкте мен соңғы топты қоссақ , онда R=n/n=1 құрылымын аламыз . Бұл тағы бір жай сақина мен одан алынатын түзу немесе тармақталған тізбекті сақиналар MnPnO3n формуласын дәлелдегендей. Екі сақинаны байланыстыратын тізбектер үшін жоғарыдағы формула сәйкес келмейді , өйткені тармақталған екі нүктені бір құрылымға біріктіру екі сақиналы топтарға тән емес . Мұндай құрылымдардың құрамы ультрафосфатты облыста жатуы тиіс.
Слайд 14ФОСФАТТАРҒА ЖАЛПЫ ФОРМУЛА
Фосфаттар үшін жалпы формуланы анықтайда M2O/P2O5 = R қатынасын есептеу

маңызды
Егер теңдеуіндегі Np мүшесін Р+Nх алмастырсақ
Алайда бұл формуланы қолдану ыңғайсыз. Сондықтан
Бұдан
M = RP = nP
nR жалпы формуладағы М шамасына теңестіріп, алынады:
немесе
Слайд 15Жалпы формуладағы О атомының индексіне соңғы шаманы қойып, фосфат формуласы алынады:
немесе
Фосфаттарға

сай R мәні:
1) фосфор бесоксидінің полимерлері үшін нөлге тең: немесе
2) ультрафосфаттар үшін бірден кіші;
3) метафосфаттар үшін бірге тең:
4) полифосфаттар үшін R = (n+2) / n:
Слайд 16ҚОРЫТЫНДЫ
Фосфатты қосылыстардың құрамындағы элементтердің арасындағы байланыс
пен олардың құрылымдық ерекшеліктері – фосфаттар технологиясы

мен
химиясындағы ең маңызды және негізгі зерттеу бағыттарының және көптеген
фосфорлы қосылыстардың басты сипаттамаларының бірі. Фосфаттардағы
байланыс пен құрылым ерекшеліктерін зерттеу арқылы мүмкін болатын фос-
фордың қосылыстарын алуға, әртүрлі зерттеулер жүргізуге, шығарып өңдеуге
мүмкін болады.













 Оксиды
Оксиды Презентация на тему Синтетические моющие средства
Презентация на тему Синтетические моющие средства  Общая характеристика галогенов. 9 класс
Общая характеристика галогенов. 9 класс Химический опыт с горением борноэтилового эфира
Химический опыт с горением борноэтилового эфира Электролиз и его применение
Электролиз и его применение Растворы
Растворы Валентность
Валентность Разбор 25 задания. Установим соответствие
Разбор 25 задания. Установим соответствие Влияние пластифицирующих добавок на свойства декоративного мелкозернистого бетона
Влияние пластифицирующих добавок на свойства декоративного мелкозернистого бетона ОГЭ №2, вопрос 1-16
ОГЭ №2, вопрос 1-16 Современные подходы к преподаванию химии
Современные подходы к преподаванию химии Электролит
Электролит Закономерности изменения свойств атомов химических элементов
Закономерности изменения свойств атомов химических элементов Полимеры
Полимеры Төртінші негізгі топша элементтері
Төртінші негізгі топша элементтері Analoghi nucleobasi
Analoghi nucleobasi Метионин
Метионин Презентация на тему Классификация неорганических веществ. Оксиды
Презентация на тему Классификация неорганических веществ. Оксиды  Терпеноиды. Эфирные масла
Терпеноиды. Эфирные масла Амины. Аминокислоты
Амины. Аминокислоты Бор и его соединения
Бор и его соединения Сложные реакции
Сложные реакции Масс-спектрометрия – аналитический метод определения молекулярной массы свободных ионов в высоком вакууме
Масс-спектрометрия – аналитический метод определения молекулярной массы свободных ионов в высоком вакууме Произведение растворимости
Произведение растворимости Превращение веществ. История химии. Автор: Рассказова Н.Л., учитель химии и биологии МОУ «СОШ №8».
Превращение веществ. История химии. Автор: Рассказова Н.Л., учитель химии и биологии МОУ «СОШ №8». Презентация на тему Полимеразная цепная реакция
Презентация на тему Полимеразная цепная реакция  Основания и кислоты в повседневной жизни
Основания и кислоты в повседневной жизни Основания. Состав оснований
Основания. Состав оснований