Содержание
- 2. Закон действия масс скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степени их стехиометрических
- 3. Задача 1. Как изменится скорость химической реакции N2 (г) + 3H2 (г) = 2NH3 (г) при
- 4. Задача 2. Как изменится скорость химической реакции 2NО (г) + О2 (г) = 2NО2 (г) а)
- 5. 2NО (г) + О2 (г) = 2NО2 (г) б) при уменьшении объема реакционного сосуда в 3
- 6. Задача 3. Найти значение константы скорости реакции А (г) + В (г) = АВ (г), если
- 7. Задача 4. Во сколько раз изменится скорость химической реакции 2А (г) + В (г) = А2В(г),
- 8. Задача 5. Во сколько раз следует увеличить концентрацию вещества В в реакции 2А (г) + В
- 9. Правило Вант-Гоффа где V1 и V2 скорость реакции при температуре t1 и t2 (t2 > t1),
- 10. Задача 6. Во сколько раз увеличится скорость химической реакции, при повышении температуры от 10 до 40
- 11. Задача 7. Температурный коэффициент скорости реакции = 2,3. Во сколько раз увеличится скорость реакции при повышении
- 12. Задача 9. Две реакции протекают при 25оС с одинаковой скоростью. У первой реакции γ1 = 2,
- 13. ХИМИЧЕСКОЕ РАВНОВЕСИЕ Обратимые реакции СО2 + Н2О СО2 + Н2 3H2 + N2 → – прямая
- 14. аА + вВ сС + dD где А и В – исходные вещества, а и в
- 15. Кр - Константа равновесия
- 16. Задача 10. Равновесие в системе 2NО2 (г) ⇄ 2NО (г) + О2 (г) установилось при следующих
- 17. [NO]2·[O2] Kp = [NO2]2 = 0,0242·0,012 0,0062 = 0,192 Найдем исходную концентрацию NO2 CNO2исх = [NO2]
- 18. Задача 11. Равновесие в системе Н2 (г) + I2 (г) ⇄ 2HI (г) установилось при следующих
- 19. Правило Ле Шателье: Если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то состояние равновесия смещается
- 20. Задача 12. В какую сторону сместиться равновесие в обратимой реакции а) при повышении температуры, б) при
- 21. б) Давление оказывает влияние на газообразные вещества. Чем больше молекул газа, тем больше давление. При повышении
- 22. Задача 13. В какую сторону сместиться равновесие в обратимой реакции а) при повышении температуры, б) при
- 24. Скачать презентацию















![[NO]2·[O2] Kp = [NO2]2 = 0,0242·0,012 0,0062 = 0,192 Найдем исходную концентрацию](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1006667/slide-16.jpg)





 Сульфаниламидные препараты. Хинолоны
Сульфаниламидные препараты. Хинолоны Основы трибологии и триботехники. Смазка и смазочные материалы
Основы трибологии и триботехники. Смазка и смазочные материалы Свойства растворов электролитов
Свойства растворов электролитов Ароматические и ненасыщенные альдегиды и кетоны
Ароматические и ненасыщенные альдегиды и кетоны Кремний. Технический кремний
Кремний. Технический кремний Парафины. Алканы
Парафины. Алканы Теория строения вещества. Межмолекулярные взаимодействия. Водородная связь. Специфические взаимодействия
Теория строения вещества. Межмолекулярные взаимодействия. Водородная связь. Специфические взаимодействия Презентация на тему Витамины. Урок химии 10 класс
Презентация на тему Витамины. Урок химии 10 класс  Образование и получение веществ. Естествознание 6 класс
Образование и получение веществ. Естествознание 6 класс Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Без золота прожить можно, без соли нельзя
Без золота прожить можно, без соли нельзя Получение кислорода. Практическая работа
Получение кислорода. Практическая работа Менделеевский период
Менделеевский период Основные понятия химической термодинамики
Основные понятия химической термодинамики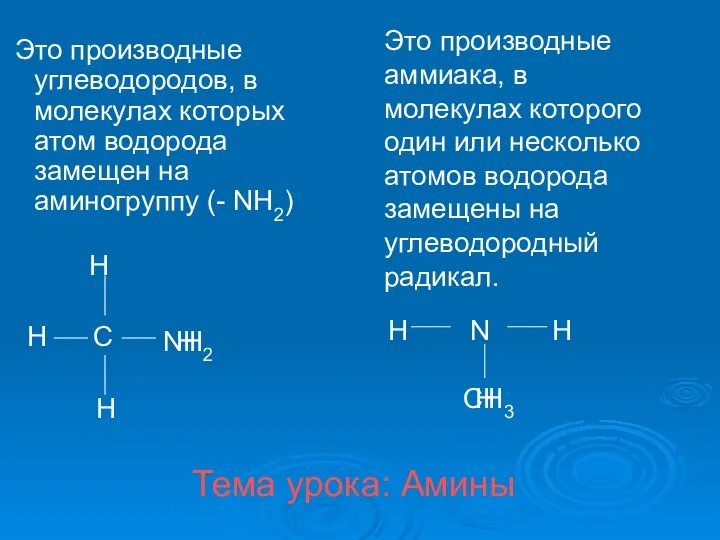 Амины. Классификация аминов
Амины. Классификация аминов Кислород и сера. Их положение в ПСХЭ. Значение и применение
Кислород и сера. Их положение в ПСХЭ. Значение и применение Выполнил ученик 9-го класса Сенов Виктор 2007-2008уч.год
Выполнил ученик 9-го класса Сенов Виктор 2007-2008уч.год Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Применение неметаллов
Применение неметаллов Алканы. Физические свойствава алканов
Алканы. Физические свойствава алканов Тестирование по химии
Тестирование по химии Геохимический барьер
Геохимический барьер Презентация на тему Окислительно – восстановительные реакции
Презентация на тему Окислительно – восстановительные реакции  Презентация на тему Азот
Презентация на тему Азот  Personal сare. Akypo Foam Rl 40
Personal сare. Akypo Foam Rl 40 Химические реакции
Химические реакции Презентация на тему Карбоновые кислоты и их производные
Презентация на тему Карбоновые кислоты и их производные  Термохимические уравнения
Термохимические уравнения