Содержание
- 2. Лекция № 1 Химическое равновесие. Протолитические равновесия и процессы в растворах электролитов
- 3. Содержание лекции 6. Степень и константа диссоциации 4. Протолитическая теория кислот и оснований 5. Протолитические равновесия
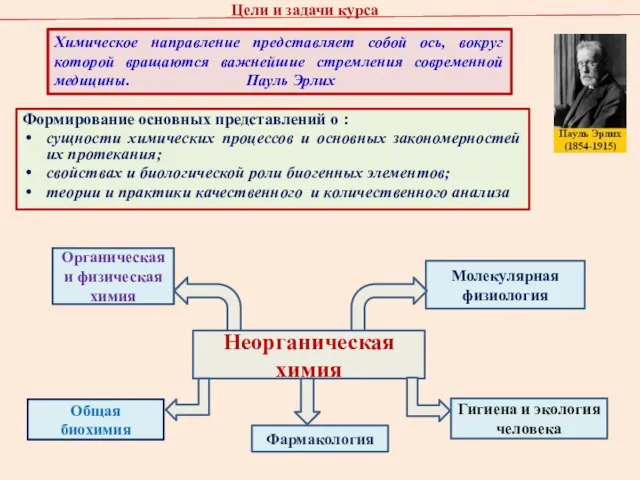
- 4. Цели и задачи курса Формирование основных представлений о : сущности химических процессов и основных закономерностей их
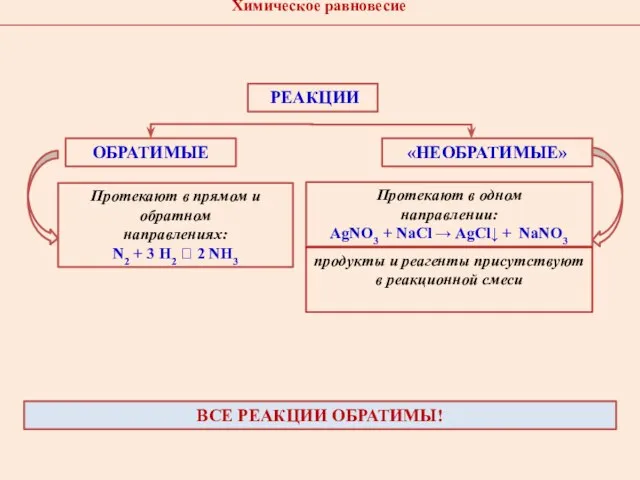
- 5. РЕАКЦИИ ОБРАТИМЫЕ «НЕОБРАТИМЫЕ» Протекают в прямом и обратном направлениях: N2 + 3 H2 ⮀ 2 NH3
- 6. Химическое равновесие ― такое состояние системы реагирующих веществ, при котором за определенный интервал времени в химическую
- 7. Фазовые равновесия: H2О(ж) ⮀ H2O(г) – выпаривание – конденсация Ассоциация - диссоциация 2NO2(г) ⮀ N2О4(г) –
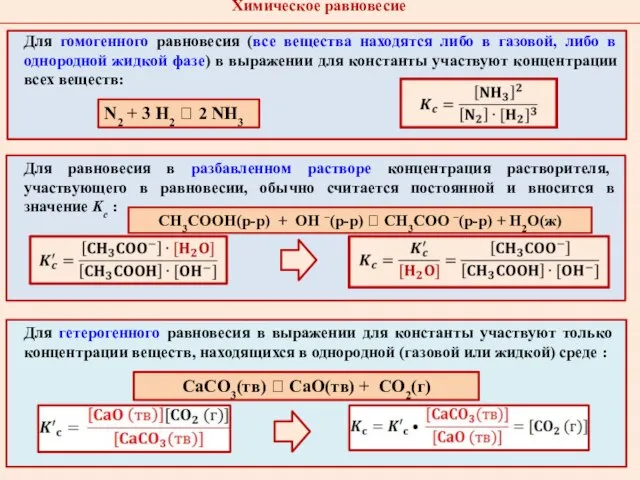
- 8. Математическое выражение для Kc из закона действующих масс: Гомогенная реакция аА + bВ ⮀ сС +
- 9. Для гомогенного равновесия (все вещества находятся либо в газовой, либо в однородной жидкой фазе) в выражении
- 10. "Изменение любого фактора, могущего влиять на состояние химического равновесия системы веществ, вызывает в ней реакцию, стремящуюся
- 11. Влияние различных факторов на равновесие а А + b В (больший объем) ⮀ с С +
- 12. Пример 1.1 Определите направление смещения равновесия в реакции: СО2(газ) + Н2О(ж) Н2СО3(раствор) + 20 кДж Давление:
- 13. [HI]2 = 50.53 · 10–6 [HI] = 7.1 · 10–3 моль/л ν(HI) = 7.1 · 10–3
- 14. H2 + I2 ⮀ 2HI x = 0.0022 моль/л Пример 1.3 В колбу объемом 5 л
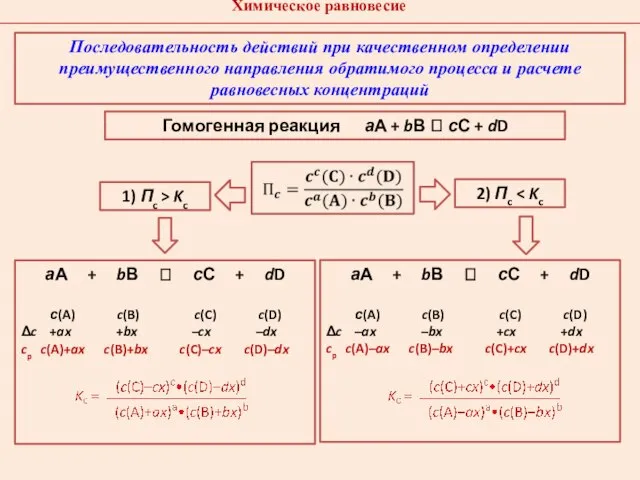
- 15. Гомогенная реакция аА + bВ ⮀ сС + dD 1) Пc > Kc 2) Пc Последовательность
- 16. Протолитические равновесия и процессы в растворах электролитов
- 17. Кислотность и основность «Классическая» теория (С. Аррениус, 1880) Кислота – донор протона; Основание – донор гидроксид-иона;
- 18. Протолитическая теория кислот и оснований (И. Брёнстед, Т. Лоури, 1923) Кислота – молекула или ион, способные
- 19. Равновесия, устанавливающиеся в растворах между кислотами и сопряженными основаниями, называются протолитическими К протолитическим реакциям относятся: –
- 20. Если в одновременно существующих равновесиях имеется одна или несколько общих частиц, то говорят о совмещенных (сопряженных,
- 21. Протолитическая теория кислот и оснований
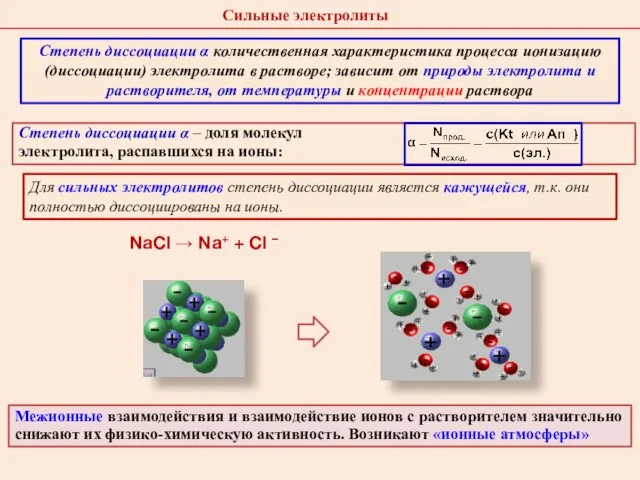
- 22. Степень диссоциации α – доля молекул электролита, распавшихся на ионы: Для сильных электролитов степень диссоциации является
- 23. Петер Дебай 1884 - 1966 Эрих Хюккель 1896 - 1980 Сильные электролиты в растворах практически полностью
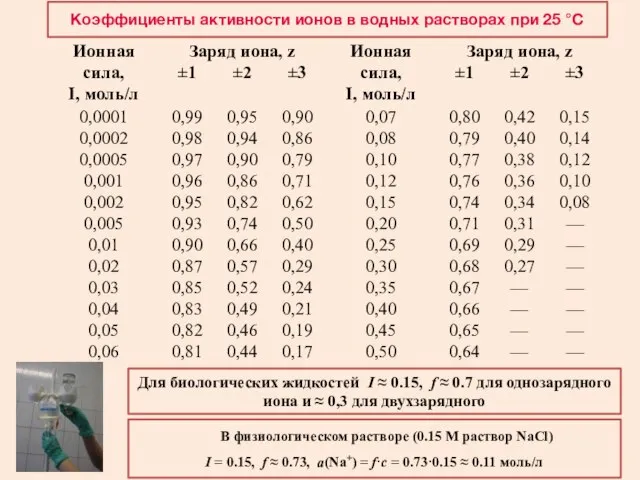
- 24. Ионная сила раствора (I) – количественная характеристика интенсивности межионных взаимодействий – величина, характеризующая интенсивность электростатического поля
- 25. Активность a – активная, т.е эффективная, концентрация, в соответствии с которой электролит ведет себя в различных
- 26. Коэффициенты активности ионов в водных растворах при 25 °С Для биологических жидкостей I ≈ 0.15, f
- 27. Водородный показатель Шкала значений водородного показателя рН Сёрен Педэр Лауриц Сёренсен 1868 - 1939 Водородный показатель
- 28. Кислотность биологических жидкостей
- 29. Для сильных кислот: рН = – lgС1/z; т.к. [H+] = C1/z, отсюда С1/z = 10–рН Для
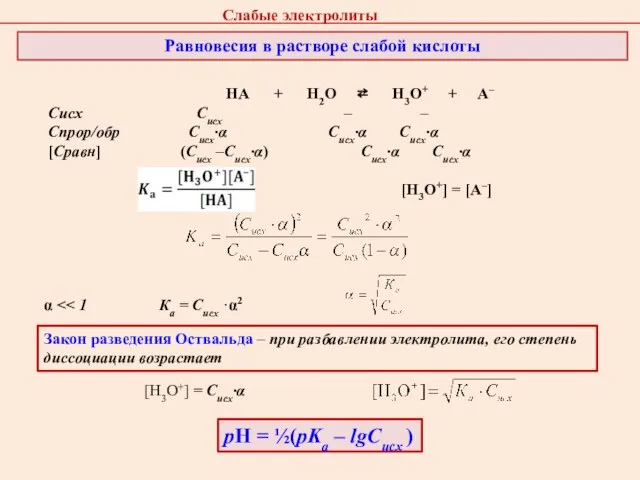
- 30. Слабые кислоты Одноосновные (СН3СООН) Двухосновные (Н2СО3) — диссоциируют ступенчато Водородный показатель
- 31. НА + Н2О ⇄ Н3О+ + А– Сисх Cисх – – Спрор/обр Cисх·α Cисх·α Cисх·α [Сравн]
- 32. Расчет рН в растворах слабых кислот Пример 2.4 Рассчитать рН в 0.1 М растворе CH3COOH (pKa
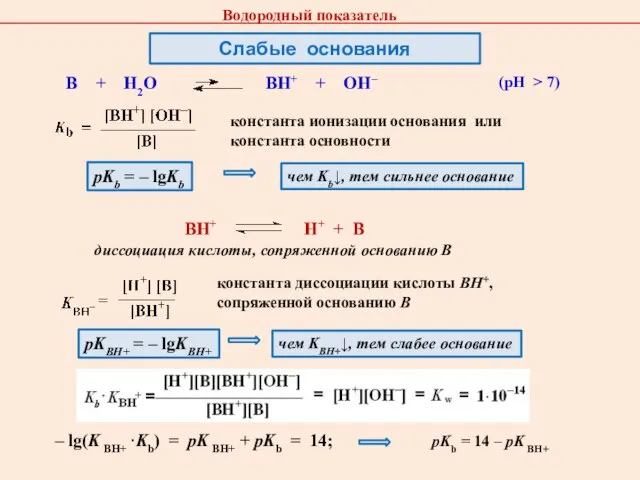
- 33. Слабые основания (pH > 7) – lg(K BH+ ·Kb) = pK BH+ + pKb = 14;
- 34. Расчет рН в растворах слабых оснований pH = ½(14 + pKBH+ + lgcB) = ½(14 +
- 35. Гидролитические равновесия в растворах солей Сольволиз – процесс взаимодействия растворенного вещества с ионами, образующимися при ионизации
- 36. Отношение солей к гидролизу Соли, образованные катионом сильного основания и сильной кислоты, гидролизу не подвергаются; рН
- 37. Константа гидролиза Kh – константа гидролитического равновесия, характеризующая процесс гидролиза Степень гидролиза h – количественная характеристика
- 38. Гидролиз по катиону NH4Cl → NH4+ + Cl– NH4+ + H2O ⇄ NH3 + H3O+ Kw
- 39. Гидролиз по аниону NaNO2 → Na+ + NO2– NO2– + H2O ⇄ HNO2 + OH– Kw
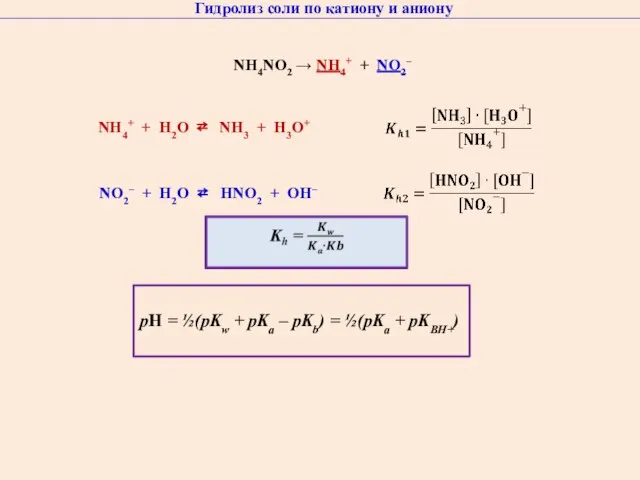
- 40. Гидролиз соли по катиону и аниону NН4NO2 → NH4+ + NO2– NO2– + H2O ⇄ HNO2
- 41. Расчет рН в растворах средних солей Пример 2.6 Рассчитать рН в 1 М растворе NH4Cl (pKBH+
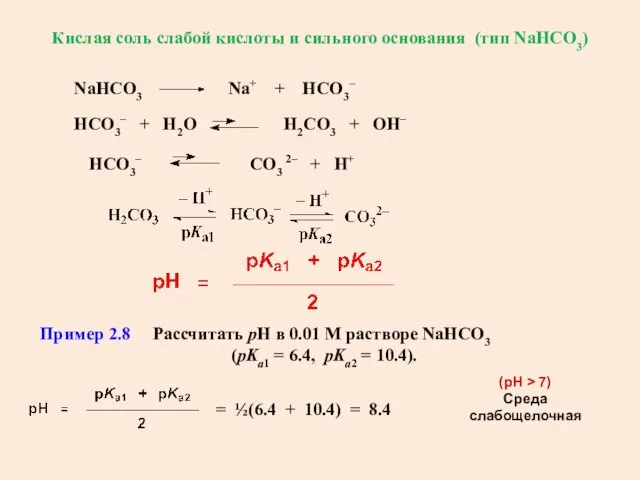
- 42. Кислая соль слабой кислоты и сильного основания (тип NaНCO3) Пример 2.8 Рассчитать рН в 0.01 М
- 43. Средние соли многоосновных кислот При расчете рН растворов средних солей многоосновных кислот используется pKa для последней
- 45. Скачать презентацию








![[HI]2 = 50.53 · 10–6 [HI] = 7.1 · 10–3 моль/л ν(HI)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/855273/slide-12.jpg)












![Для сильных кислот: рН = – lgС1/z; т.к. [H+] = C1/z, отсюда](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/855273/slide-28.jpg)










 Алмазы
Алмазы Идентификация эфедрина гидрохлорида и дэфедрина
Идентификация эфедрина гидрохлорида и дэфедрина Презентация на тему Применение спиртов
Презентация на тему Применение спиртов  Презентация на тему Химические свойства алкенов
Презентация на тему Химические свойства алкенов  Комплексонометрическое титрование. 5 лекция. Часть 2
Комплексонометрическое титрование. 5 лекция. Часть 2 Экзаменационные билеты
Экзаменационные билеты Классификация видов износа
Классификация видов износа Металлы и их соединения
Металлы и их соединения Нанотехнологии в быту
Нанотехнологии в быту Повторение по химии (8 класс)
Повторение по химии (8 класс) Биосинтез фенольных соединений в растениях
Биосинтез фенольных соединений в растениях Химическая связь
Химическая связь Эквивалент. Закон эквивалентов
Эквивалент. Закон эквивалентов Алканы
Алканы Круговорот азота
Круговорот азота Явления, смеси и способы их разделения
Явления, смеси и способы их разделения Многоатомные спирты
Многоатомные спирты Работа ученика 9 «в» класса МОУ «СОШ №59» Попова Михаила Руководитель Самсонова Г.М.
Работа ученика 9 «в» класса МОУ «СОШ №59» Попова Михаила Руководитель Самсонова Г.М. Эпоксидті полимер материалдарының қасиеттерін зерттеу
Эпоксидті полимер материалдарының қасиеттерін зерттеу Глюконеогенез. Суммарное уравнение реакций глюконеогенеза
Глюконеогенез. Суммарное уравнение реакций глюконеогенеза Презентация по Химии "Схема получения моноизотопного кремния"
Презентация по Химии "Схема получения моноизотопного кремния"  Своя игра по химии
Своя игра по химии Предпосылки открытия Периодического закона Д. И. Менделеевым
Предпосылки открытия Периодического закона Д. И. Менделеевым Условия, замедляющие выход водорастворимых питательных веществ из удобрений на примере аммофоса
Условия, замедляющие выход водорастворимых питательных веществ из удобрений на примере аммофоса Наноматеріали. Тіт Лукрецій Кар
Наноматеріали. Тіт Лукрецій Кар Капиллярное поднятие жидкости
Капиллярное поднятие жидкости Круговорот азота в природе
Круговорот азота в природе Презентация на тему Химические реакции
Презентация на тему Химические реакции