Содержание
- 2. К какому классу соединений относятся формулы веществ? Назовите их. H2SO4 Na2O Ba(OH)2 H2CO3 N2O5 KOH
- 3. О каком веществе идёт речь? У травоядных животных потребность в этом веществе велика. В тех странах,
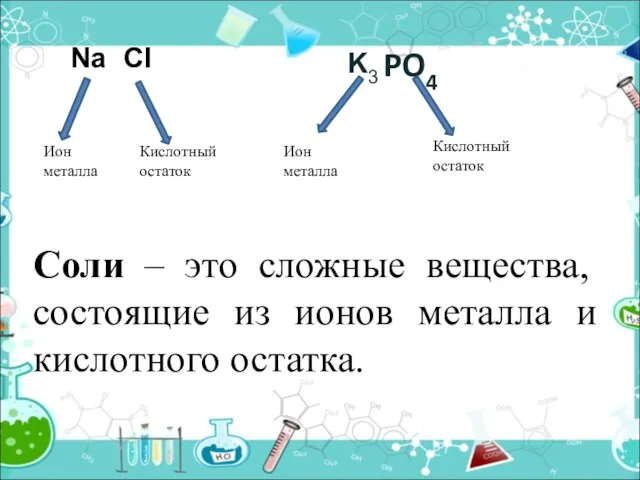
- 4. PO4 Ион металла Кислотный остаток Ион металла Кислотный остаток Na Cl K3 Соли – это сложные
- 5. Найдите среди формул веществ- формулы солей CO2 H2 SO4 CaO BaSO4 K2SO4 Fe(OH)3 HCl MgCO3 H2O
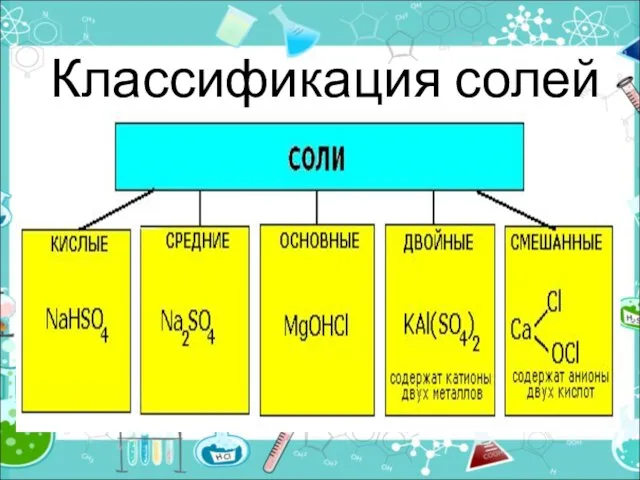
- 6. Классификация солей
- 7. Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на атомы металла (KCl) Кислые
- 8. Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей
- 9. Номенклатура средних солей магния Название кислотного остатка Наименование металла в родительном падеже МgСL2 хлорид
- 10. Номенклатура кислых солей Указать название кислотного остатка К названию кислотного остатка прибавить «гидро-» Наименование металла в
- 11. Номенклатура основных солей Указать название кислотного остатка К названию кислотного остатка прибавить «основной-» Наименование металла в
- 12. Номенклатура двойных солей таллия (I) -натрия Название кислотного остатка Наименование металлов в родительном падеже NaTl(NO3)2 нитрат
- 13. Номенклатура смешанных солей кальция Название кислотных остатков Наименование металла в родительном падеже CaCLOCL хлорид-гипохлорит
- 14. Составить формулы солей: нитрита магния, силиката натрия, фосфата кальция.
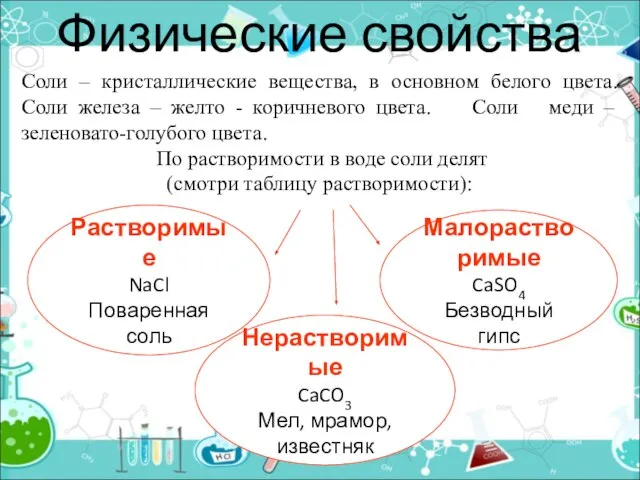
- 15. Физические свойства Растворимые NaCl Поваренная соль Соли – кристаллические вещества, в основном белого цвета. Соли железа
- 16. Способы получения 1. Кислота + основание = соль + вода H2SO4 +2NaOH = Na2SO4 + 2H2O
- 17. Способы получения 5. Основание + соль = новое основание + новая соль 2КОН + СаSO4 =
- 18. Применение солей Соли соляной кислоты. Из хлоридов больше всего используют хлорид натрия и хлорид калия. Хлорид
- 19. Применение солей Соли серной кислоты. В строительстве и в медицине широко используют полуводный гипс, получаемый при
- 20. Применение солей Соли азотной кислоты. Нитраты больше всего используют в качестве удобрений в сельском хозяйстве. Важнейшим
- 21. Применение солей Соли угольной кислоты. Карбонат кальция используют в качестве сырья для получения извести. Карбонат натрия
- 22. О соли Мёртвое море
- 23. Розовое озеро в Сенегале Это озеро имеет такой цвет из-за большого количества микроорганизмов и полезных ископаемых.
- 24. Самое большое солевое озеро в мире расположено на юге пустынной равнины Альтиплано, в Боливии, на высоте
- 26. Скачать презентацию




















 Сучкова Н.В. учитель химии первой квалификационной категории 2008-2009 учебный год
Сучкова Н.В. учитель химии первой квалификационной категории 2008-2009 учебный год Презентация на тему Органическая химия. Жиры
Презентация на тему Органическая химия. Жиры  Решение расчетных задач по химии
Решение расчетных задач по химии Органическая химия. Получение альдегидов и кетонов
Органическая химия. Получение альдегидов и кетонов Химия. 8 класс. Подготовка к контрольной работе
Химия. 8 класс. Подготовка к контрольной работе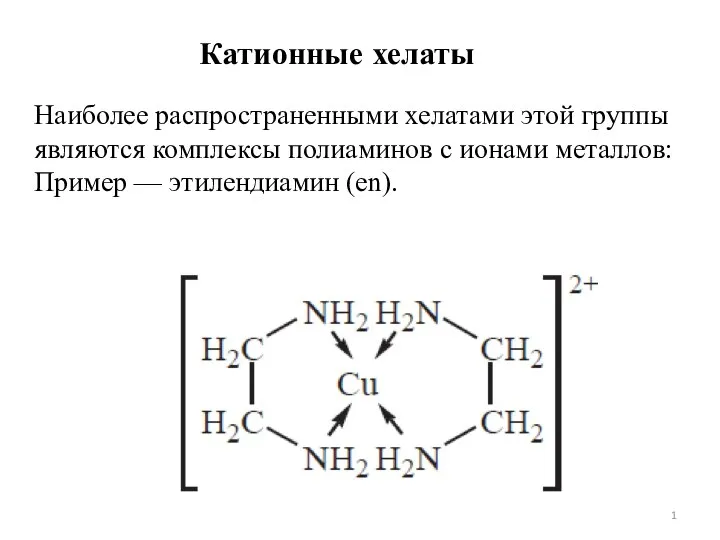 Хелатный эффект. Лекция 7
Хелатный эффект. Лекция 7 Влияние растворителей на скорость органических реакций. (Лекция 10)
Влияние растворителей на скорость органических реакций. (Лекция 10)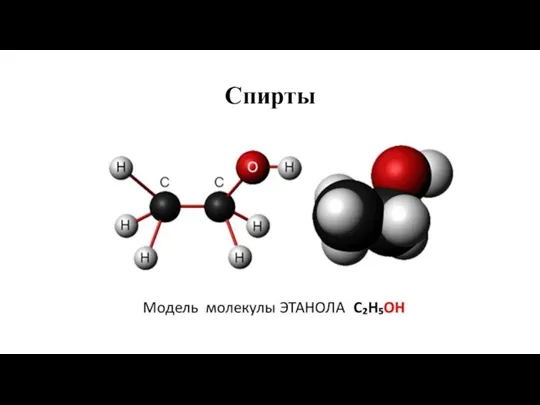 Спирты
Спирты Основы химической термодинамики
Основы химической термодинамики Кислород
Кислород Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Классы неорганических соединений
Классы неорганических соединений Презентация на тему Электролиты
Презентация на тему Электролиты  Бор и его соединения
Бор и его соединения Пиримидин (шестичленный гетероцикл с двумя атомами азота)
Пиримидин (шестичленный гетероцикл с двумя атомами азота) Эмульсии как лиофобные дисперсные системы
Эмульсии как лиофобные дисперсные системы Материальные и энергетические балансы. Тема 2
Материальные и энергетические балансы. Тема 2 Диэлектрики
Диэлектрики Презентация на тему Всё о кремнии
Презентация на тему Всё о кремнии  Химическая связь. Описание ковалентной химической связи методом молекулярных орбиталей
Химическая связь. Описание ковалентной химической связи методом молекулярных орбиталей Термохимия. Закон Гесса. Следствия из закона Гесса
Термохимия. Закон Гесса. Следствия из закона Гесса Предельные углеводороды. Алканы (1)
Предельные углеводороды. Алканы (1) Химический элемент. Изотопы. Ионы
Химический элемент. Изотопы. Ионы Изомерия. Виды изомерии
Изомерия. Виды изомерии Химия крови. Диффузия, тургор, осмос в клетке
Химия крови. Диффузия, тургор, осмос в клетке Классы неорганических веществ. Оксиды
Классы неорганических веществ. Оксиды Պոլիմերներ
Պոլիմերներ Свойства неметаллов и их соединений
Свойства неметаллов и их соединений