Содержание
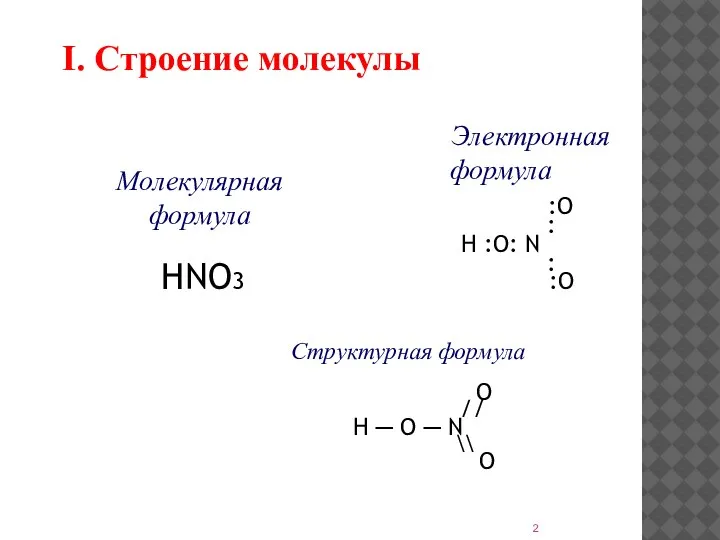
- 2. I. Строение молекулы Электронная формула :O : H :O: N : :O Структурная формула O //
- 3. По основности: одноосновная По содержанию «О»: кислородсодержащая По растворимости в воде: растворимая По стабильности: нестабильная По
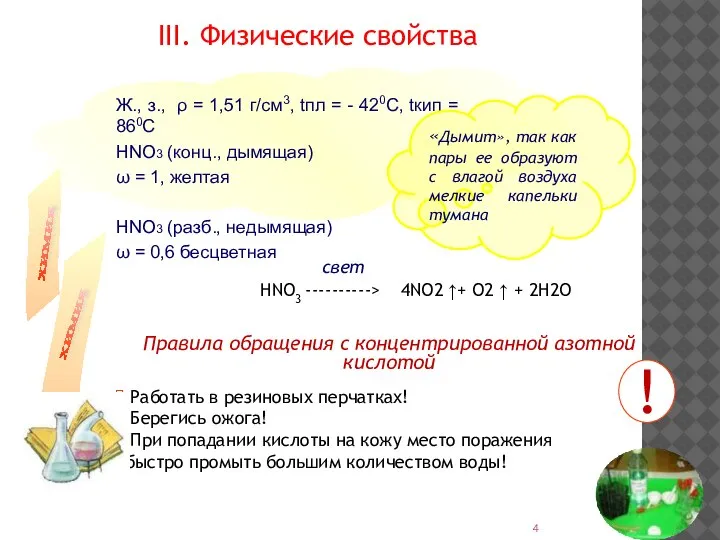
- 4. Ж., з., ρ = 1,51 г/см3, tпл = - 420С, tкип = 860С НNO3 (конц., дымящая)
- 5. Получение ГЛАУБЕР Иоганн Рудольф (1604-1670), немецкий химик и врач. Получил чистую азотную кислоту в 1650 году.
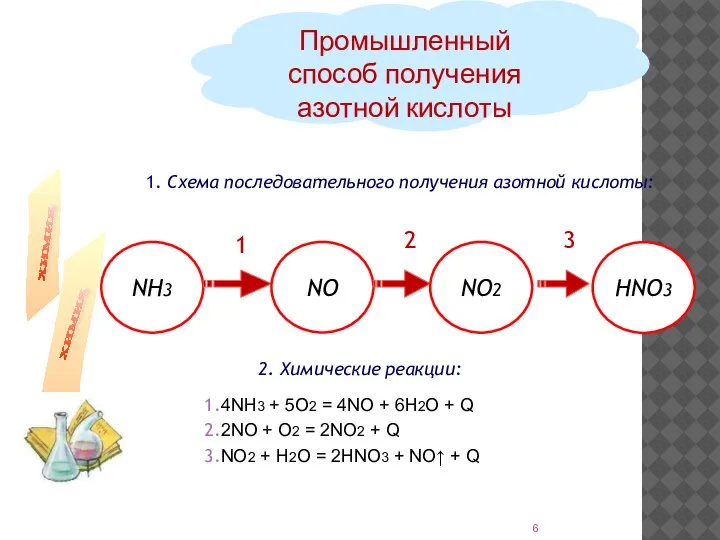
- 6. 1. Схема последовательного получения азотной кислоты: Промышленный способ получения азотной кислоты 2. Химические реакции: 1 2
- 7. «Азотная кислота по характеру среди своих подруг - самая сильная и уверенная в себе . Внешне
- 8. I. Общие с другими кислотами НNO3 + лакмус фиолетовый = НNO3 + метиловый оранжевый = НNO3
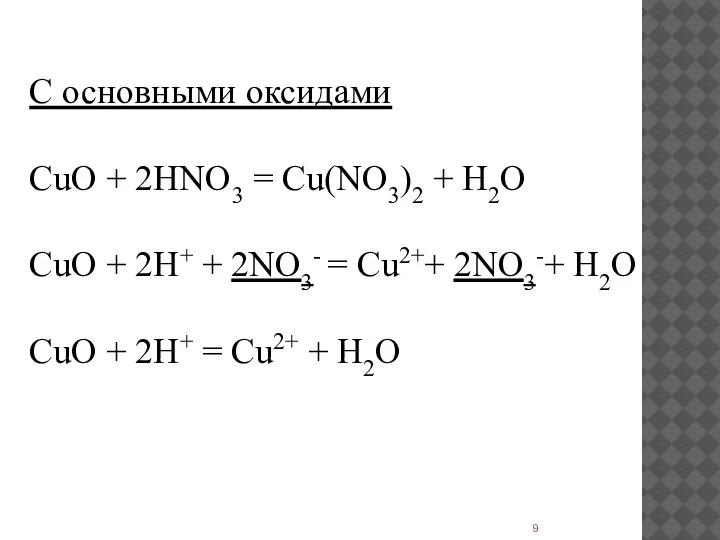
- 9. С основными оксидами CuO + 2HNO3 = Cu(NO3)2 + H2O CuO + 2H+ + 2NO3- =
- 10. С основаниями (нерастворимыми): Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O Cu(OH)2 + 2H++ 2NO 3- =
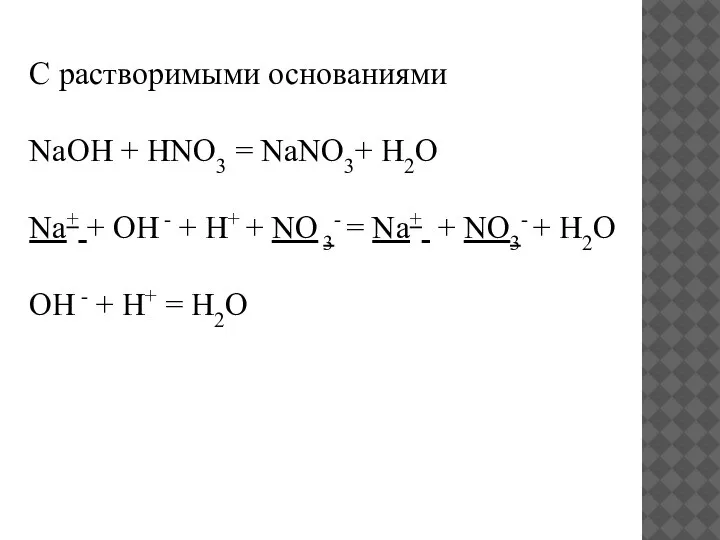
- 11. С растворимыми основаниями NaOH + HNO3 = NaNO3+ H2O Na+ + OH - + H+ +
- 12. C солями (более слабых кислот): Na2CO3 + 2HNO3 = 2NaNO3 + CO2+ H2O 2Na+ + CO32
- 13. ВЗАИМОДЕЙСТВИЕ С НЕМЕТАЛЛАМИ неметалл + HNO3(разб.) → соединение неметалла в высшей степени окисления + NO неметалл
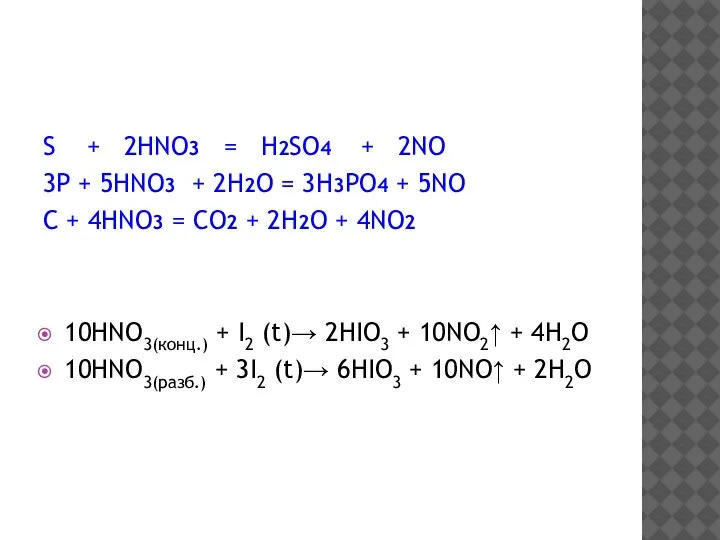
- 14. S + 2HNO3 = H2SO4 + 2NO 3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO
- 15. ВЗАИМОДЕЙСТВИЕ С ОРГАНИЧЕСКИМИ СОЕДИНЕНИЯМИ С белками – появление ярко-желтого окрашивания С бензолом – получение взрывчатых веществ
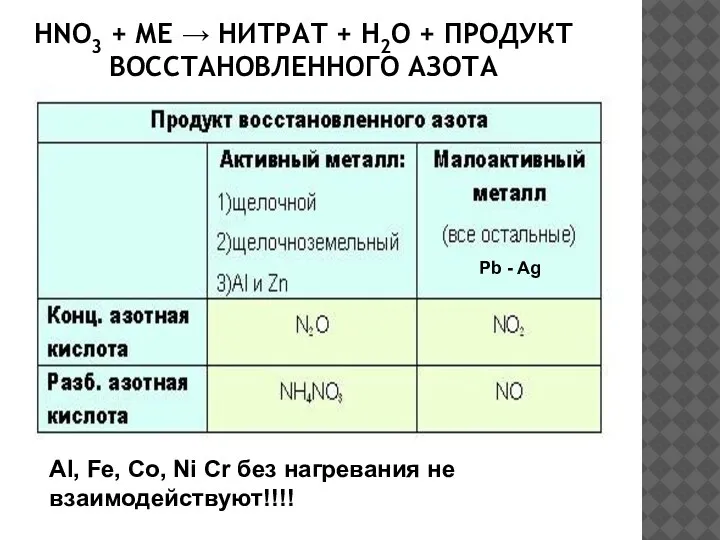
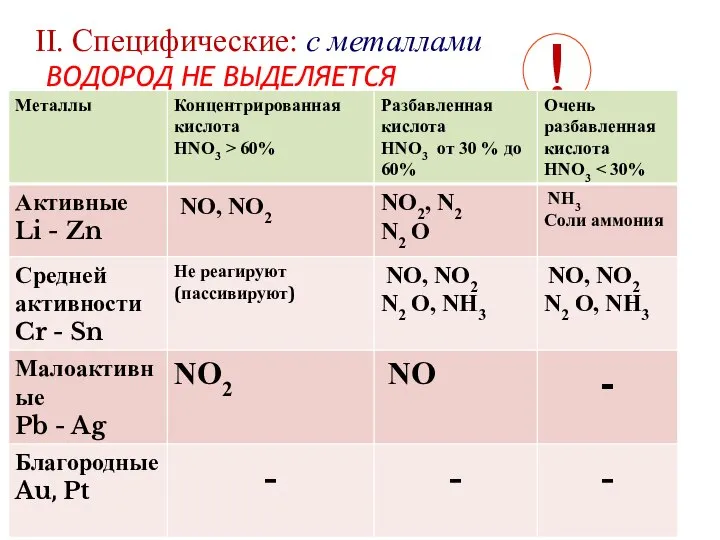
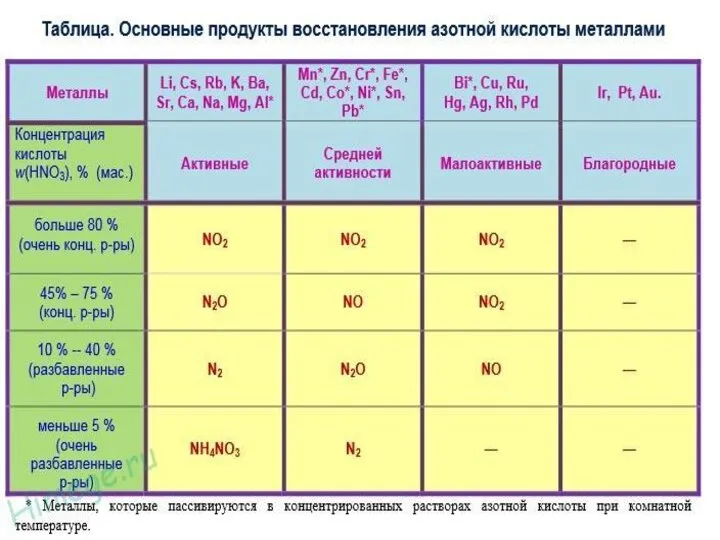
- 16. HNO3 + МЕ → НИТРАТ + H2O + ПРОДУКТ ВОССТАНОВЛЕННОГО АЗОТА Al, Fe, Co, Ni Cr
- 17. II. Cпецифические: с металлами ВОДОРОД НЕ ВЫДЕЛЯЕТСЯ !
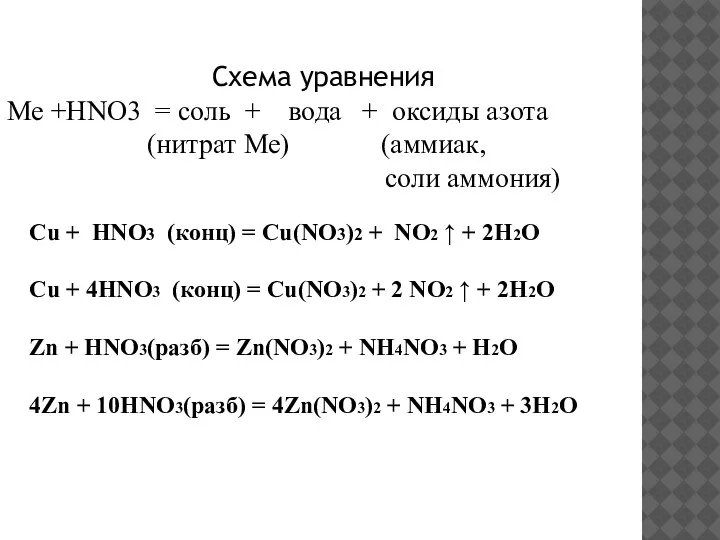
- 19. Схема уравнения Ме +HNO3 = соль + вода + оксиды азота (нитрат Ме) (аммиак, соли аммония)
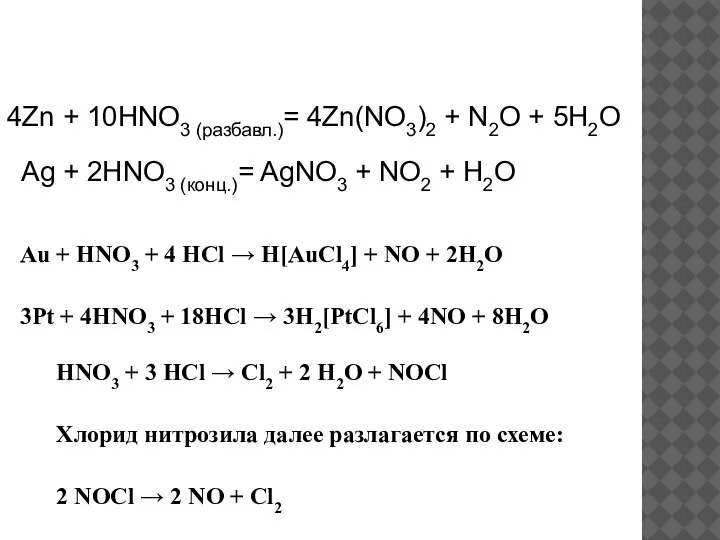
- 20. 4Zn + 10HNO3 (разбавл.)= 4Zn(NO3)2 + N2O + 5H2O Ag + 2HNO3 (конц.)= AgNO3 + NO2
- 21. 4HNO3 = 4 NO2 + 2 H2O + O2.
- 23. Скачать презентацию







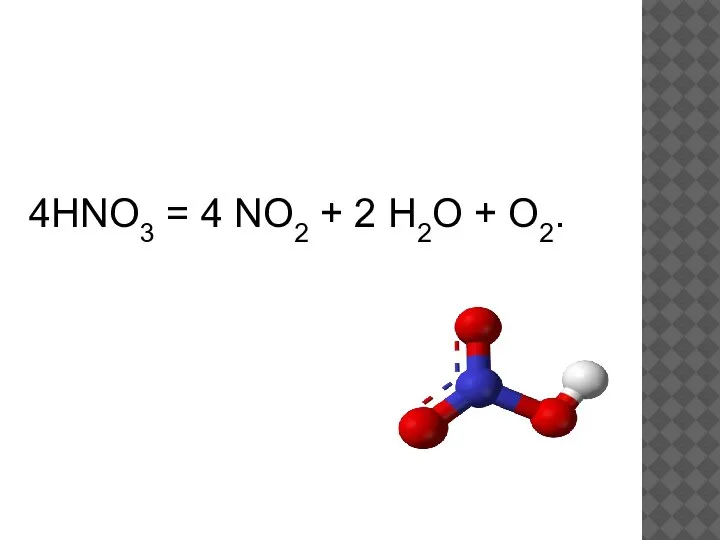
 Обратимые и необратимые химические реакции. Химическое равновесие
Обратимые и необратимые химические реакции. Химическое равновесие Кислоты. Общая формула кислот
Кислоты. Общая формула кислот Натуральный каучук
Натуральный каучук Стекло. Виды стекла
Стекло. Виды стекла Электролиз и его применение
Электролиз и его применение Мемо-химия. Защита проекта
Мемо-химия. Защита проекта Изменения, происходящие с веществами
Изменения, происходящие с веществами Ароматические углеводороды. Арены
Ароматические углеводороды. Арены Исследование возможности создания порохов на основе 1,1диамино-2,2-динитроэтилена
Исследование возможности создания порохов на основе 1,1диамино-2,2-динитроэтилена Значение воды на Земле
Значение воды на Земле Многообразие органических веществ
Многообразие органических веществ Нуклеиновые кислоты
Нуклеиновые кислоты Заполни электронные уровни элементов
Заполни электронные уровни элементов Основы химической термодинамики и термохимии
Основы химической термодинамики и термохимии Уксусная кислота
Уксусная кислота Лекарственные средства – производные пиримидина
Лекарственные средства – производные пиримидина Презентация на тему Химия наука о веществах
Презентация на тему Химия наука о веществах  Карбонильные соединения (альдегиды)
Карбонильные соединения (альдегиды) Относительная молекулярная масса вещества
Относительная молекулярная масса вещества Алкены. Гомологический ряд алкенов. Изомерия алкенов
Алкены. Гомологический ряд алкенов. Изомерия алкенов Дополнительный_материал_11.15_23.09.2022_e4f87550
Дополнительный_материал_11.15_23.09.2022_e4f87550 Качественные реакции в химии
Качественные реакции в химии Презентация на тему Основные законы химии
Презентация на тему Основные законы химии  Методика измерений массовой концентрации ионов аммония в природных и сточных водах фотометрическим методом с реактивом Несслера
Методика измерений массовой концентрации ионов аммония в природных и сточных водах фотометрическим методом с реактивом Несслера Химическая связь
Химическая связь Полимеры. Виды полимеров
Полимеры. Виды полимеров Оксиды и гидроксиды
Оксиды и гидроксиды Контроль якості імуногематологічних досліджень за допомогою діагностичних моноклональних реагентів та стандартних еритроцитів
Контроль якості імуногематологічних досліджень за допомогою діагностичних моноклональних реагентів та стандартних еритроцитів