Содержание
- 2. ИЗОТОПЫ – разновидности одного и того же химического элемента, близкие по своим физико-химическим свойствам, но имеющие
- 3. Атом любого химического элемента состоит из положительно заряженного ядра и окружающего его облака отрицательно заряженных электронов.
- 4. В 1932 был открыт нейтрон – частица, не имеющая заряда, с массой, близкой к массе ядра
- 5. В природе встречаются как стабильные изотопы, так и нестабильные – радиоактивные, ядра атомов которых подвержены самопроизвольному
- 6. Открытие изотопов В 1808 английский ученый натуралист Джон Дальтон впервые ввел определение химического элемента как вещества,
- 7. Важным шагом на пути к открытию изотопов стало обнаружение явления радиоактивности и сформулированная Эрнстом Резерфордом и
- 8. Независимое подтверждение существования стабильных изотопов было затем получено в экспериментах Томсона и Астона в 1912–1920 с
- 9. Применение изотопов Разнообразные изотопы химических элементов находят широкое применение в научных исследованиях, в различных областях промышленности
- 10. Изотопные технологии находят широкое применение в медицине. Так в США, согласно статистическим данным, проводится более 36
- 12. Скачать презентацию
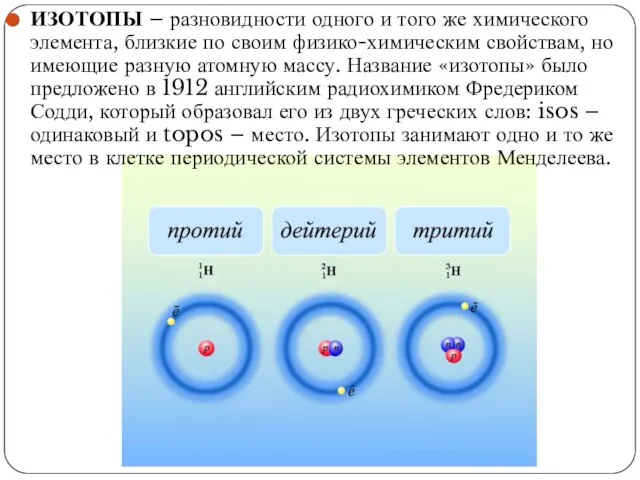
Слайд 2ИЗОТОПЫ – разновидности одного и того же химического элемента, близкие по своим
ИЗОТОПЫ – разновидности одного и того же химического элемента, близкие по своим
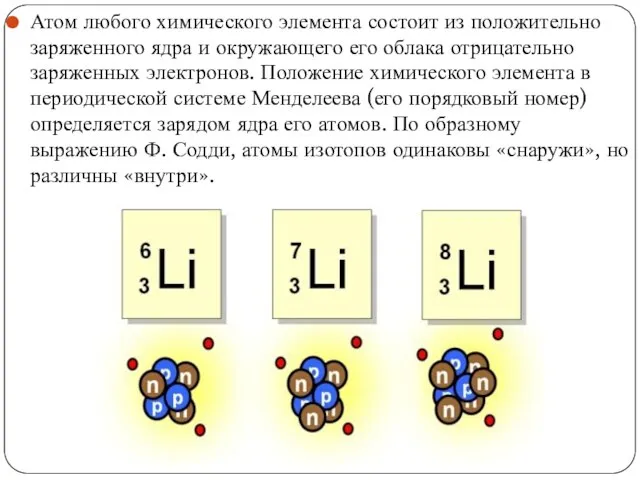
Слайд 3Атом любого химического элемента состоит из положительно заряженного ядра и окружающего его
Атом любого химического элемента состоит из положительно заряженного ядра и окружающего его
Слайд 4В 1932 был открыт нейтрон – частица, не имеющая заряда, с массой,
В 1932 был открыт нейтрон – частица, не имеющая заряда, с массой,

Из всех известных нам изотопов только изотопы водорода имеют собственные названия. Так, изотопы 2H и 3H носят названия дейтерия и трития.
Слайд 5В природе встречаются как стабильные изотопы, так и нестабильные – радиоактивные, ядра
В природе встречаются как стабильные изотопы, так и нестабильные – радиоактивные, ядра

Слайд 6Открытие изотопов
В 1808 английский ученый натуралист Джон Дальтон впервые ввел определение химического
Открытие изотопов
В 1808 английский ученый натуралист Джон Дальтон впервые ввел определение химического

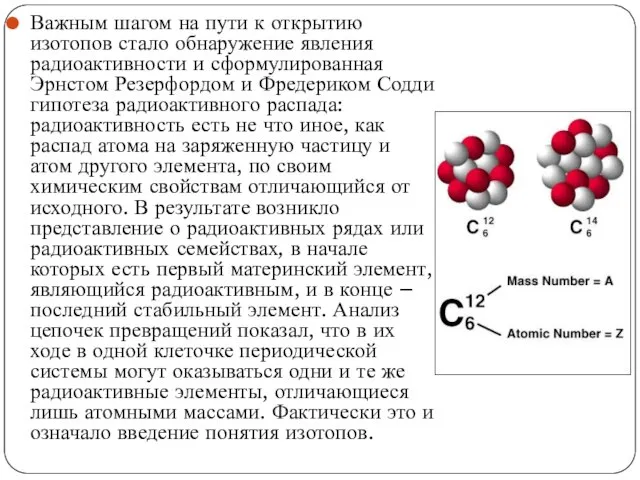
Слайд 7Важным шагом на пути к открытию изотопов стало обнаружение явления радиоактивности и
Важным шагом на пути к открытию изотопов стало обнаружение явления радиоактивности и
Слайд 8Независимое подтверждение существования стабильных изотопов было затем получено в экспериментах Томсона и
Независимое подтверждение существования стабильных изотопов было затем получено в экспериментах Томсона и

В 1919 Астон сконструировал прибор, названный масс-спектрографом. В качестве источника ионов по-прежнему использовалась разрядная трубка, однако Астон нашел способ, при котором последовательное отклонение пучка частиц в электрическом и магнитном полях приводило к фокусировке частиц с одинаковым значением отношения заряда к массе (независимо от их скорости) в одной и той же точке на экране. В результате последующего использования и усовершенствования масс-спектрометров усилиями многих исследователей к 1935 году была составлена почти полная таблица изотопных составов химических элементов.
Слайд 9Применение изотопов
Разнообразные изотопы химических элементов находят широкое применение в научных исследованиях, в
Применение изотопов
Разнообразные изотопы химических элементов находят широкое применение в научных исследованиях, в

Слайд 10Изотопные технологии находят широкое применение в медицине. Так в США, согласно статистическим
Изотопные технологии находят широкое применение в медицине. Так в США, согласно статистическим

 Спирты
Спирты Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Примеры реакций в жизни и в быту
Примеры реакций в жизни и в быту Количественный анализ. Титрование
Количественный анализ. Титрование Основания. Классификация
Основания. Классификация Углеводы (Сахариды)
Углеводы (Сахариды) Титриметрический анализ. Основные понятия
Титриметрический анализ. Основные понятия Пищевая химия
Пищевая химия Катализ
Катализ Кислородные соединения углерода
Кислородные соединения углерода 4. Диаграмма железо-углерод
4. Диаграмма железо-углерод Коррозия Автор: Резванова Дарья Ученица 8 класса ГБОУ СОШ №484 Руководитель Бирюкова З.В. Учитель химии ГБОУ СОШ №484 г.Санкт – П
Коррозия Автор: Резванова Дарья Ученица 8 класса ГБОУ СОШ №484 Руководитель Бирюкова З.В. Учитель химии ГБОУ СОШ №484 г.Санкт – П Молярный объем газов
Молярный объем газов Порядок в жидкостях
Порядок в жидкостях Презентация по Химии "Конструкции из стекла"
Презентация по Химии "Конструкции из стекла"  Алкены. Решение задач и упражнений
Алкены. Решение задач и упражнений Характеристика переходного элемента на основании его положения в периодической системе Д.И. Менделеева
Характеристика переходного элемента на основании его положения в периодической системе Д.И. Менделеева Красители vs пигменты
Красители vs пигменты Уравнения диссоциации
Уравнения диссоциации Нефть. Способы переработки нефти
Нефть. Способы переработки нефти Презентация на тему Игра по химии «Остров Периодическая Система»
Презентация на тему Игра по химии «Остров Периодическая Система»  Лабораторная работа №1. Получение гидроксидов цинка и алюминия и исследование их свойств
Лабораторная работа №1. Получение гидроксидов цинка и алюминия и исследование их свойств Периодическая система химических элементов Д.И.Менделеева I
Периодическая система химических элементов Д.И.Менделеева I 691614
691614 Защитить кабель. Задача 9
Защитить кабель. Задача 9 Схема интеграции пентозофосфатного шунта с гликолизом
Схема интеграции пентозофосфатного шунта с гликолизом Альдегиды, их химические и физические свойства. Получение и применение альдегидов
Альдегиды, их химические и физические свойства. Получение и применение альдегидов Презентация на тему Платина
Презентация на тему Платина