Содержание
- 2. СЕРА Аллотропные модификации серы Применение серы Сера в природе Физические свойства Химические свойства Получение серы
- 3. Чтобы изучить свойства вещества необходимо знать его электронное строение Лайнус Полинг
- 4. ПЛАН ХАРАКТЕРИСТИКИ 1. Название, химический символ и относительная атомная масса элемента. 2. Атомный (порядковый) номер. 3.
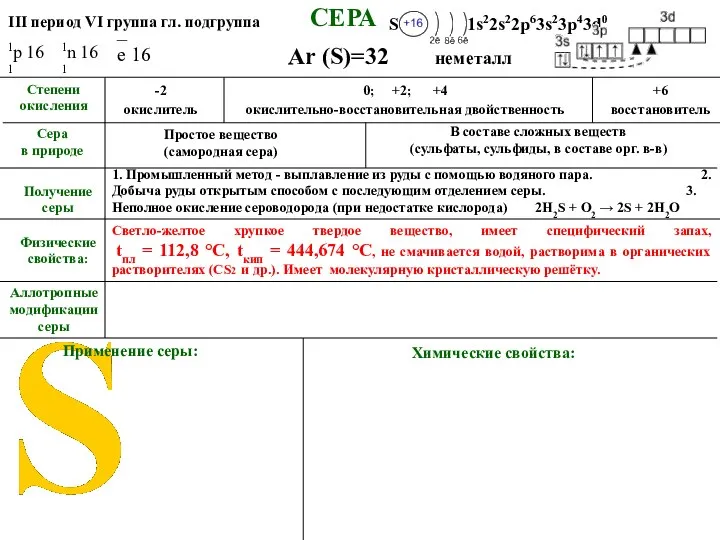
- 5. СЕРА Аллотропные модификации серы Ar (S)=32 Сера в природе Применение серы Химические свойства неметалл III период
- 6. Французский химик. Один из основоположников классической химии. Ввел в химию строгие количественные методы исследования. Доказал сложный
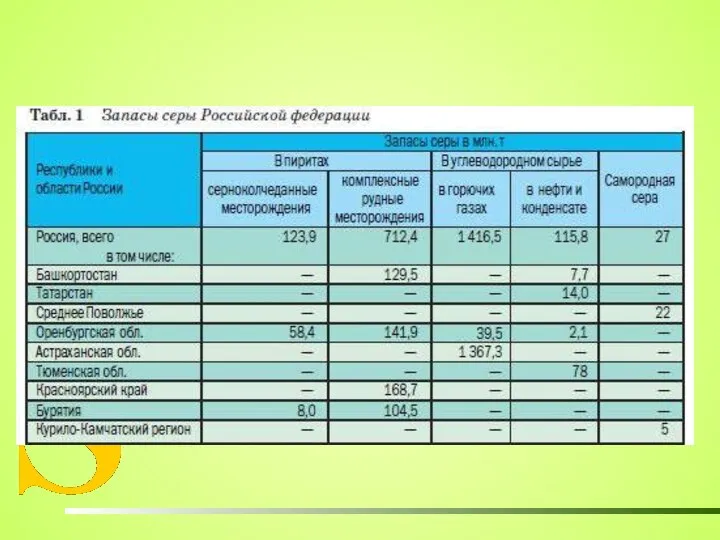
- 7. СЕРА В ПРИРОДЕ «Нет ни единой руды, нет почти ни единого камня, который бы через взаимное
- 8. ПРИРОДНЫЕ МЕСТОРОЖДЕНИЯ СЕРЫ
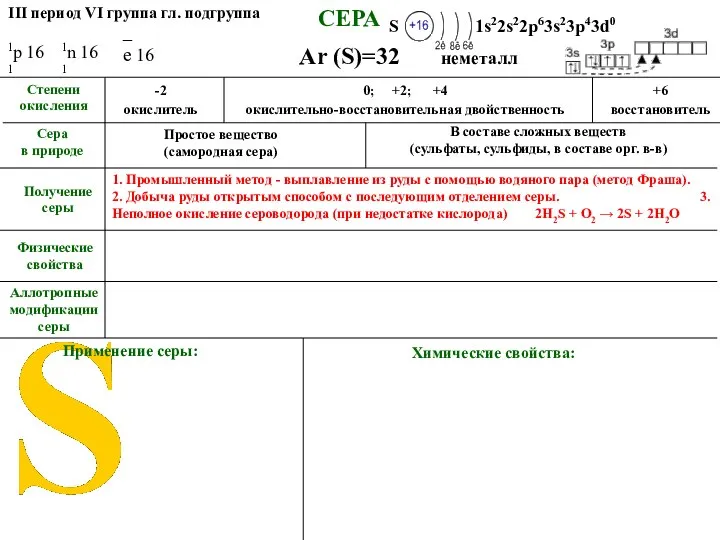
- 10. СЕРА Аллотропные модификации серы Ar (S)=32 Применение серы: Степени окисления Сера в природе Получение серы Простое
- 11. ПОЛУЧЕНИЕ СЕРЫ Метод Фраша. Выплавление серы под землёй с помощью водяного пара и выкачивание на поверхность
- 12. СЕРА Аллотропные модификации серы Ar (S)=32 Применение серы: Степени окисления Сера в природе Простое вещество (самородная
- 13. КРИСТАЛЛИЧЕСКАЯ СЕРА
- 14. СЕРА Светло-желтое хрупкое твердое вещество, имеет специфический запах, tпл = 112,8 °C, tкип = 444,674 °C,
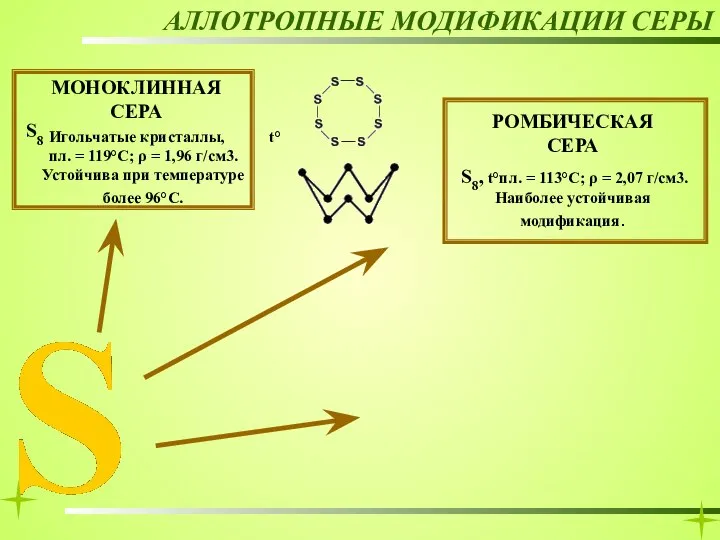
- 15. РОМБИЧЕСКАЯ СЕРА АЛЛОТРОПНЫЕ МОДИФИКАЦИИ СЕРЫ МОНОКЛИННАЯ СЕРА Игольчатые кристаллы, t°пл. = 119°C; ρ = 1,96 г/см3.
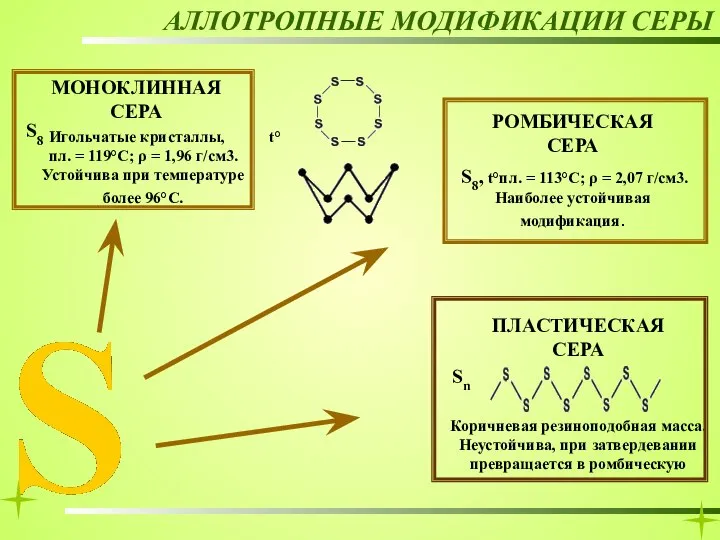
- 17. РОМБИЧЕСКАЯ СЕРА АЛЛОТРОПНЫЕ МОДИФИКАЦИИ СЕРЫ МОНОКЛИННАЯ СЕРА ПЛАСТИЧЕСКАЯ СЕРА Игольчатые кристаллы, t°пл. = 119°C; ρ =
- 18. СЕРА Светло-желтое хрупкое твердое вещество, в чистом виде без запаха, tпл = 112,8 °C, tкип =
- 19. ХИМИЧЕСКИЕ СВОЙСТВА СЕРЫ ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ Hg + S = HgS (при н.у. медленно) 2Al +
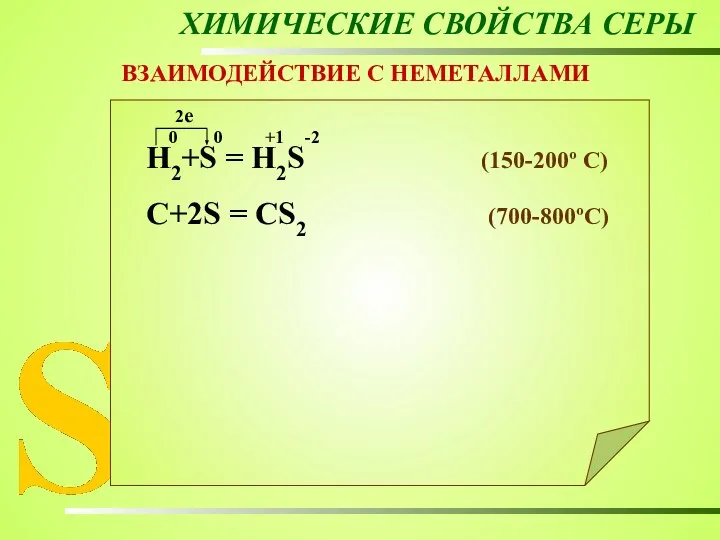
- 20. ХИМИЧЕСКИЕ СВОЙСТВА СЕРЫ ВЗАИМОДЕЙСТВИЕ С НЕМЕТАЛЛАМИ Н2+S = Н2S (150-200º C) C+2S = CS2 (700-800ºC) 0
- 21. СЕРА Светло-желтое хрупкое твердое вещество, в чистом виде без запаха, tпл = 112,8 °C, tкип =
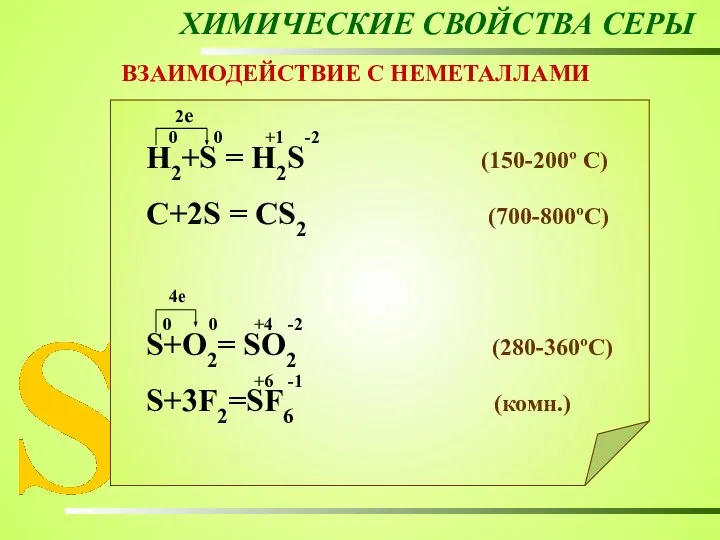
- 22. ХИМИЧЕСКИЕ СВОЙСТВА СЕРЫ ВЗАИМОДЕЙСТВИЕ С НЕМЕТАЛЛАМИ Н2+S = Н2S (150-200º C) C+2S = CS2 (700-800ºC) S+O2=
- 23. СЕРА Светло-желтое хрупкое твердое вещество, в чистом виде без запаха, tпл = 112,8 °C, tкип =
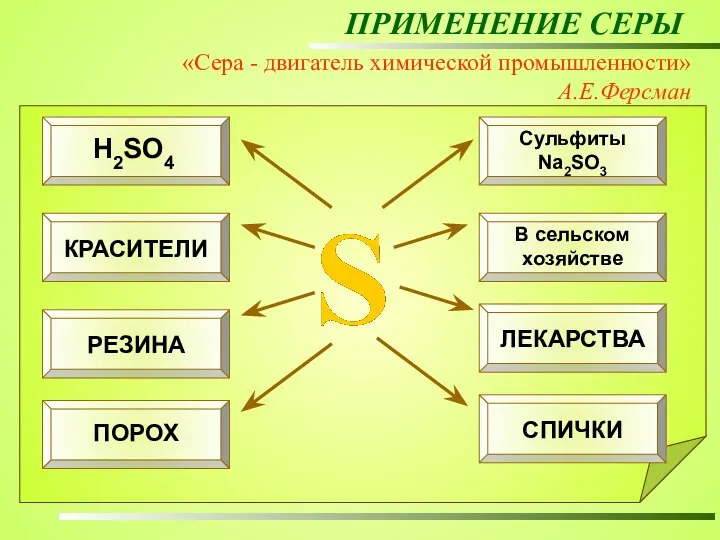
- 24. ПРИМЕНЕНИЕ СЕРЫ «Сера - двигатель химической промышленности» А.Е.Ферсман Для того чтобы изготовить автомобиль, нужно израсходовать около
- 25. БИОЛОГИЧЕСКАЯ РОЛЬ СЕРЫ Жизненно важный элемент для высших организмов, составная часть многих белков, концентрируется в волосах.
- 26. СЕРА Светло-желтое хрупкое твердое вещество, в чистом виде без запаха, tпл = 112,8 °C, tкип =
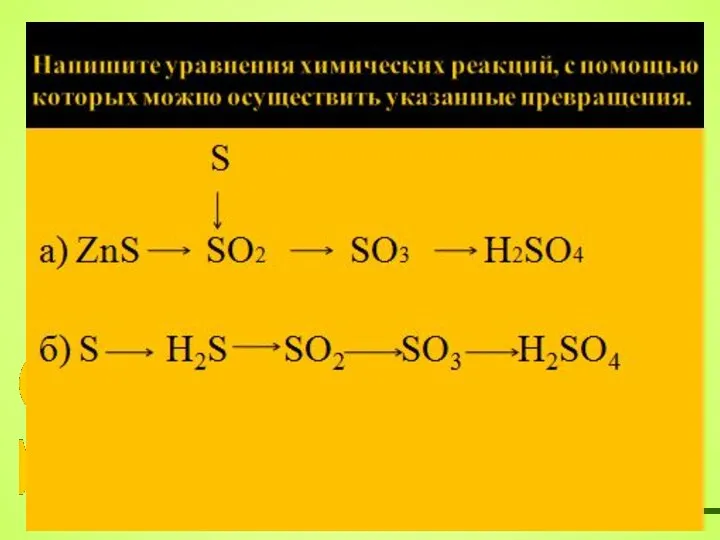
- 28. Задача: Каков объём (н.у.) а) сернистого газа получится при обжиге на воздухе 120г пирита FeS2; б)
- 30. Скачать презентацию















 Строение атома. Периодический закон
Строение атома. Периодический закон Решение экспериментальных задач по теме Металлы
Решение экспериментальных задач по теме Металлы Важнейшие соединения хлора
Важнейшие соединения хлора Хром. Месторождения
Хром. Месторождения Синтетические органические соединения
Синтетические органические соединения Презентация на тему Алхимики
Презентация на тему Алхимики  Домашняя работа на каникулы
Домашняя работа на каникулы Сера, соединения серы
Сера, соединения серы Химические реакции. Реакции по фазовому составу
Химические реакции. Реакции по фазовому составу Чемпионат НХЛ (национальной химической лиги)
Чемпионат НХЛ (национальной химической лиги) Геохимический анализ поверхностных вод Звенигородской биостанции
Геохимический анализ поверхностных вод Звенигородской биостанции Вещество. Простые и сложные вещества
Вещество. Простые и сложные вещества Простые вещества - металлы
Простые вещества - металлы Превращения в нашей жизни: физические и химические
Превращения в нашей жизни: физические и химические Материаловедение. Легированные стали и сплавы. (Тема 11)
Материаловедение. Легированные стали и сплавы. (Тема 11) Невидиме чорнило
Невидиме чорнило Алмаз. Свойства алмазов
Алмаз. Свойства алмазов Кислородсодержащие органические соединения. Многоатомные спирты
Кислородсодержащие органические соединения. Многоатомные спирты Презентация - Крахмал - подготовительная группа
Презентация - Крахмал - подготовительная группа Добыча золота в России По теме «Внешние эффекты и права собственности»
Добыча золота в России По теме «Внешние эффекты и права собственности» Карбоновые кислоты
Карбоновые кислоты Типы кристаллических решеток
Типы кристаллических решеток Презентация на тему Типы химических реакций на примере свойств воды
Презентация на тему Типы химических реакций на примере свойств воды  Алюминий. Из истории открытия
Алюминий. Из истории открытия Синтетические душистые вещества
Синтетические душистые вещества Сказка о братьях карбонатах
Сказка о братьях карбонатах Кетоновые тела
Кетоновые тела Простые вещества - неметаллы
Простые вещества - неметаллы