Содержание
- 2. Тема урока: Фосфорная кислота и ее свойства.
- 3. Сегодня на уроке мы должны: Образовательные: Изучить физические и химические свойства фосфорной кислоты через проведение химического
- 4. Сегодня на уроке мы должны: План: 1. Молекулярная формула фосфорной кислоты. 2. Получение и физические свойства.
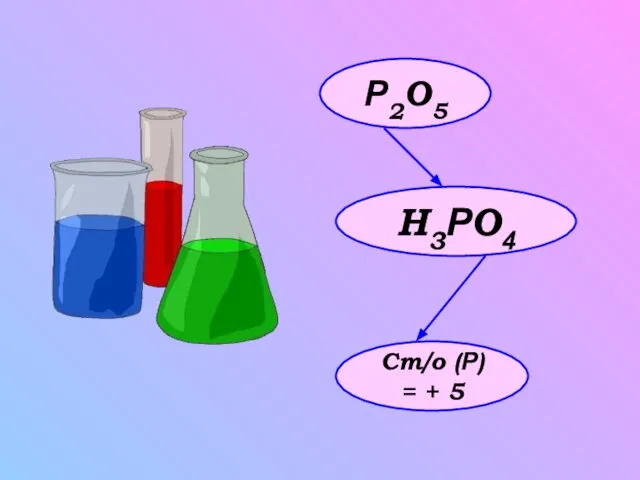
- 5. Р2O5 H3РO4 Ст/о (Р) = + 5
- 6. Молекулярная формула фосфорной кислоты и физические свойства: твердое бесцветное, кристаллическое вещество, хорошо растворимое в воде в
- 7. Производство фосфорной кислоты. а) Горение фосфора в ложечке, которую вносят в колбу. 2Р+5О2 = Р2О5 После
- 8. Химические свойства общие с другими кислотами: Водный раствор кислоты изменяет окраску индикаторов. Диссоциирует в 3 ступени:
- 9. Специфические свойства фосфорной кислоты: 6 а) При нагревании постепенно превращается в метафосфорную кислоту 2Н3РО4 = Н4Р2О7
- 10. H3РO4
- 11. Выберите вещества с которыми будет реагировать фосфорная кислота: КОН, Си, К2SО3, СО2, NО? 2. Какому молекулярному
- 13. Скачать презентацию








 10_KhimiaKlassifikatsia_organicheskikh_soedieniy (1)
10_KhimiaKlassifikatsia_organicheskikh_soedieniy (1) Замедленное коксование гудрона
Замедленное коксование гудрона Оксиды в свете ТЭД
Оксиды в свете ТЭД Иерархия классов методов моделирования. Атомистические и микроскопические методы
Иерархия классов методов моделирования. Атомистические и микроскопические методы Амфотерные гидроксиды
Амфотерные гидроксиды Тесты по химии (вопросы)
Тесты по химии (вопросы) Натуральный каучук
Натуральный каучук Презентация на тему Из чего сделаны северные трубопроводы
Презентация на тему Из чего сделаны северные трубопроводы  Простые вещества - металлы
Простые вещества - металлы Общая характеристика элементов IIА группы
Общая характеристика элементов IIА группы Вывод формул химических веществ
Вывод формул химических веществ Химия в косметике
Химия в косметике Простые вещества - неметаллы
Простые вещества - неметаллы Алкадиены: кумулированные, сопряженные, изолированные
Алкадиены: кумулированные, сопряженные, изолированные Zirconium Dioxide
Zirconium Dioxide Приходченко ФЕР-2031
Приходченко ФЕР-2031 Методы восстановления. Формирование СН-связей декарбоксилированием и декарбонилированием
Методы восстановления. Формирование СН-связей декарбоксилированием и декарбонилированием Периодическая система Д.И.Менделеева
Периодическая система Д.И.Менделеева Предельные углеводороды. Алканы
Предельные углеводороды. Алканы Сравнение активностей металлов
Сравнение активностей металлов Силумины. Виды силуминов
Силумины. Виды силуминов Современные представления о механизме реакций отщепления. Спектр механизмов E1-E2-E1cB. Диаграммы Дженкса-О’Феррола
Современные представления о механизме реакций отщепления. Спектр механизмов E1-E2-E1cB. Диаграммы Дженкса-О’Феррола Алкины. Строение алкинов
Алкины. Строение алкинов Значение воды на Земле
Значение воды на Земле Химическое равновесие в гомогенных системах
Химическое равновесие в гомогенных системах Чистые вещества и смеси
Чистые вещества и смеси Сырьё для каменного литья и производства минеральной ваты
Сырьё для каменного литья и производства минеральной ваты Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены