Содержание
- 2. Открытие электрона 1855 г.-Гейслер ( стеклянные сосуды особой формы) 1875г.-У.Крукс ( сконструировал трубку в которой можно
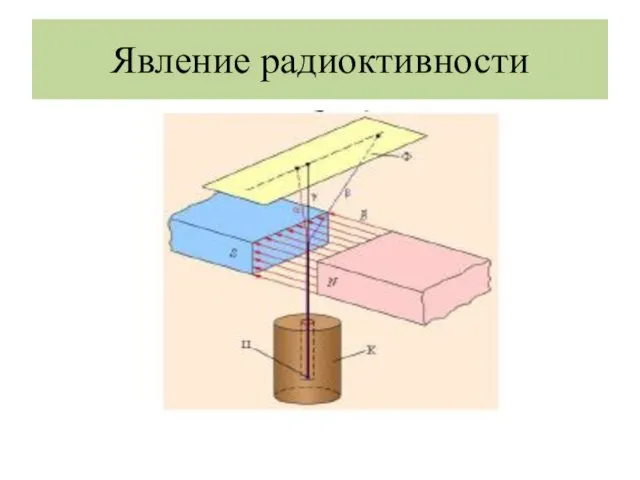
- 3. Явление радиоктивности
- 4. Планетарная модель атома модель Резерфорда недостатки
- 5. Строение атома по Бору
- 6. Строение атома по Бору Первый постулат Электроны могут обращаться вокруг ядра атома только по строго определенным,
- 7. Строение атома по Бору
- 8. Строение атома по Бору
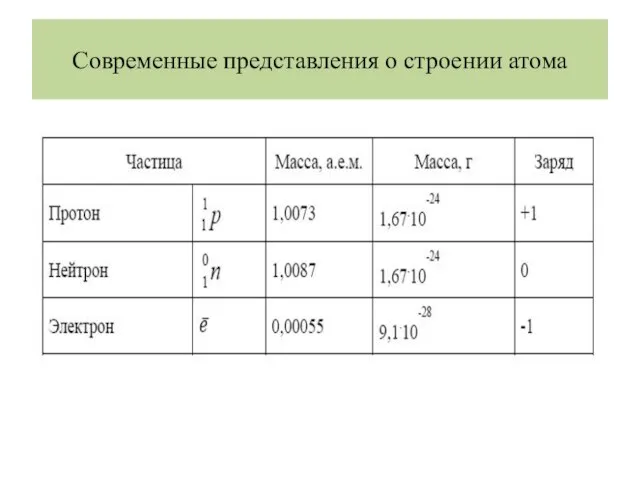
- 9. Современные представления о строении атома
- 10. Уравнение М.Планка
- 11. Уравнение де Бройля
- 12. Принцип неопределенности В.Гейзенберга
- 13. Принцип неопределенности В.Гейзенберга
- 14. Квантовые числа
- 15. Квантовые числа n-главное квантовое число, может принимать только целочисленные значения: 1,2,3,4 и т.д. Оно показывает среднее
- 16. Квантовые числа
- 17. Формы электронных орбиталей
- 18. Квантовые числа
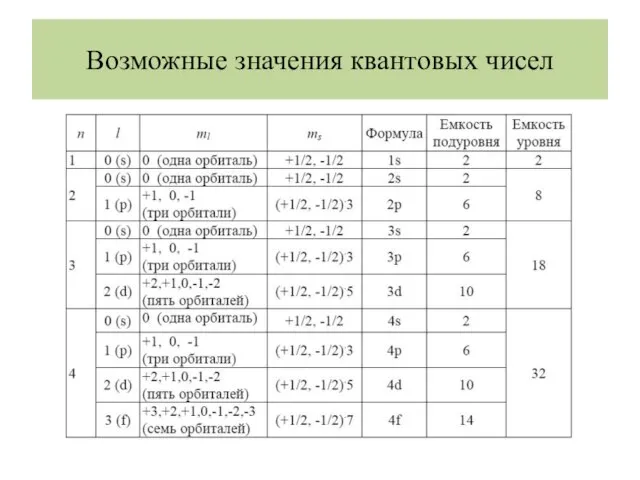
- 19. Возможные значения квантовых чисел
- 20. Заполнение электронами электронных орбиталей многоэлектронных атомов
- 21. Заполнение электронами электронных орбиталей многоэлектронных атомов
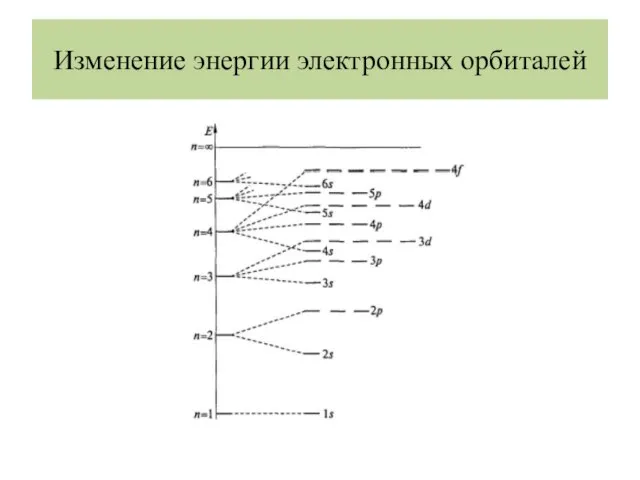
- 22. Изменение энергии электронных орбиталей
- 23. Принцип Паули ( запрет Паули)
- 24. Электронная емкость
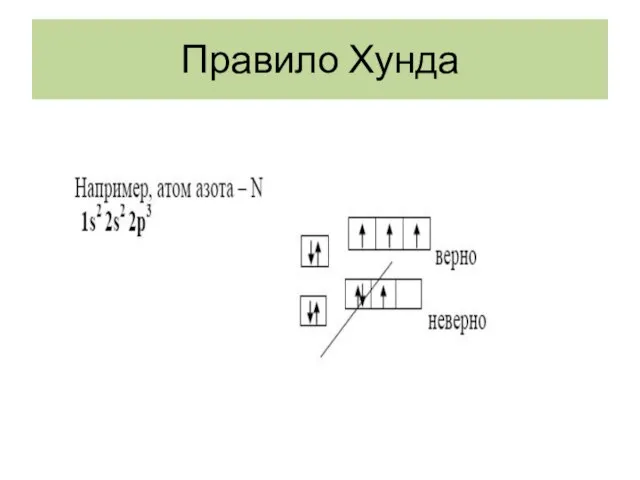
- 25. Правило Хунда
- 26. Правило Хунда
- 27. Основные характеристики атомов
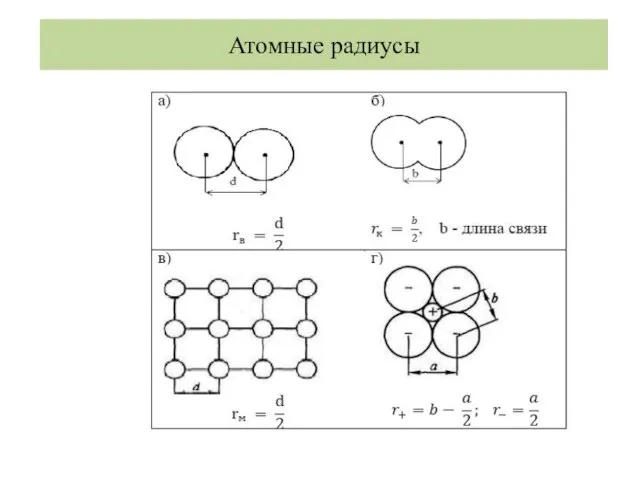
- 28. Атомные радиусы
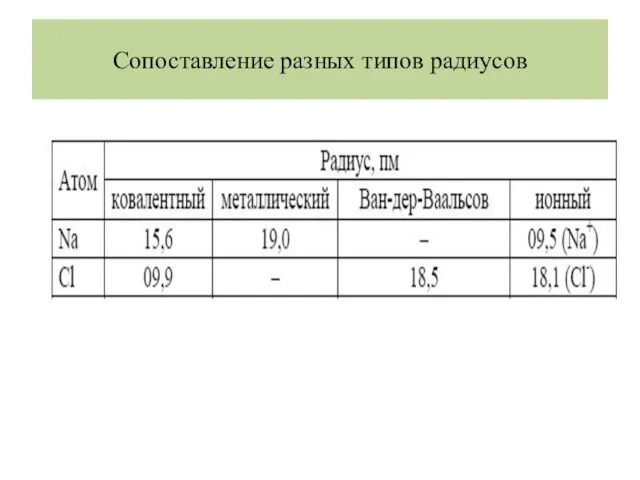
- 29. Сопоставление разных типов радиусов
- 30. Потенциал ионизации
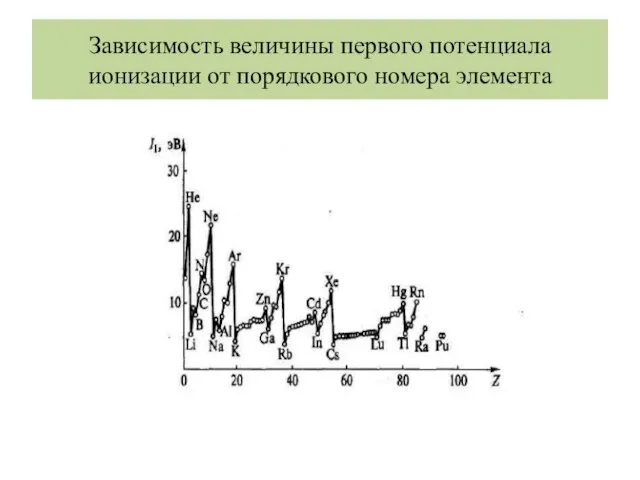
- 31. Зависимость величины первого потенциала ионизации от порядкового номера элемента
- 32. Потенциал ионизации
- 33. Потенциал ионизации
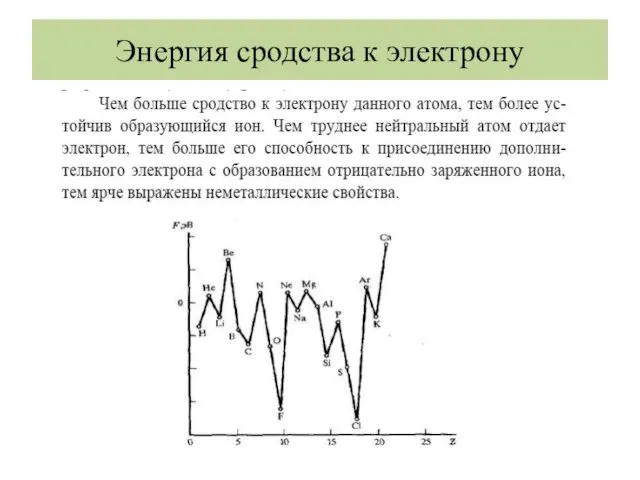
- 34. Энергия сродства к электрону
- 35. Энергия сродства к электрону
- 36. Электроотрицательность
- 38. Скачать презентацию


























 Средства для мытья окон
Средства для мытья окон Химические свойства оснований
Химические свойства оснований Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Занимательная химия Программу составил
Занимательная химия Программу составил  Щелочные металлы и их соединения
Щелочные металлы и их соединения Этиленовые углеводороды
Этиленовые углеводороды Презентация на тему Алюминий(Al)
Презентация на тему Алюминий(Al)  Природный газ
Природный газ Обмен углеводов
Обмен углеводов Химические свойства производных бензола с непредельного ряда радикалом
Химические свойства производных бензола с непредельного ряда радикалом Решение задач на Углеводороды
Решение задач на Углеводороды Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6]
Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6] Реакторы периодического действия. (Лекция 4)
Реакторы периодического действия. (Лекция 4) Химический состав продуктов питания
Химический состав продуктов питания Комплексные соединения
Комплексные соединения Презентация на тему Альдегиды
Презентация на тему Альдегиды 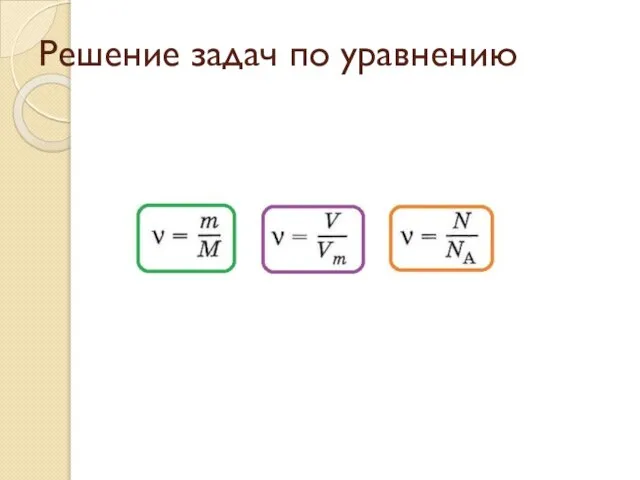 Решение задач по уравнению
Решение задач по уравнению Многогранность- моё второе имя. Задача
Многогранность- моё второе имя. Задача Альдегиды и кетоны
Альдегиды и кетоны Аминокислоты. Белки. Лекция 2
Аминокислоты. Белки. Лекция 2 Подгруппа азота
Подгруппа азота Растворы. Лекция 7
Растворы. Лекция 7 Нуклеиновые кислоты
Нуклеиновые кислоты Химия элементов (IБ) группы
Химия элементов (IБ) группы Непредельные углеводороды
Непредельные углеводороды Азотная кислота
Азотная кислота Алмаз, бриллиант
Алмаз, бриллиант Циклоалканы
Циклоалканы