Содержание
- 2. Методы выделения и разделения Соосаждения Ионообменный Экстракционный Электрохимический Хроматографический
- 3. Соосаждение Различают адсорбционное и сокристаллизационное соосаждение. Соосаждение -это процесс, в котором микрокомпонент увлекается из раствора макрокомпонентом
- 4. По механизму соосаждение может происходить путем: сокристаллизации, при котором микрокомпонент распределяется по всему объему твердой фазы,
- 5. Изоморфизм Изоморфными являются одинаковые по химическому составу вещества, сходных по свойствам химических элементов, которые кристаллизуются в
- 6. 2) Смешанные кристаллы II рода (изоморфизм внедрения). Атомы второго компонента занимают пустоты в решетке первого. Пример,
- 7. 4) гриммовские смешанные кристаллы (изоморфизм по Гримму-Гольдшмидту), то есть возникновение участков кристаллов одного компонента в другом.
- 8. Отличие истинного соосаждения от адсорбционного Истинное соосаждение – соосаждение, при котором микрокомпонент распределяется по всему объему
- 9. ЗАКОН ХЛОПИНА Если два вещества являются изоморфными или изодиморфными и концентрация одного из них мала, то
- 10. Уравнение Гендерсона и Кречека
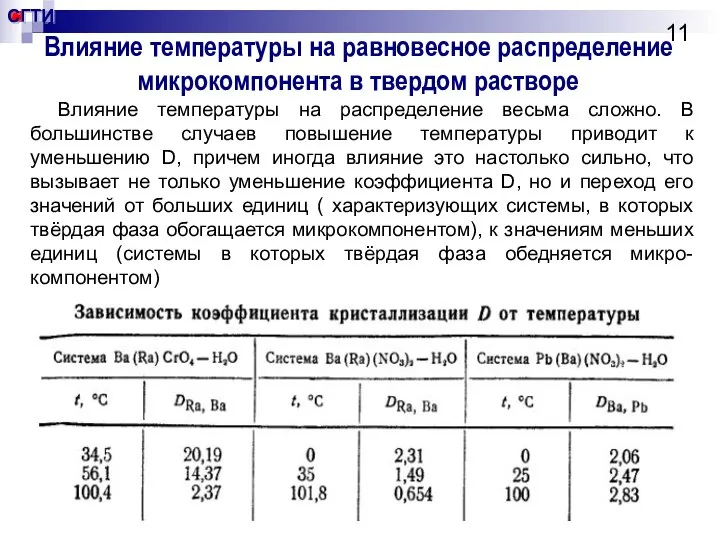
- 11. Влияние температуры на равновесное распределение микрокомпонента в твердом растворе Влияние температуры на распределение весьма сложно. В
- 12. Влияние состава жидкой фазы При изменении состава жидкой фазы коэффициент кристаллизации D практически не меняется, если
- 13. Влияние состава твердой фазы Плавное изменение состава твердой фазы путем плавного введения в раствор второго макрокомпонента,
- 14. Влияние второго микрокомпонента Если в растворе присутствуют два не взаимодействующих друг с другом микрокомпонента и внедрение
- 15. Распределение микрокомпонента между твердой фазой и расплавом Установлено, что распределение микрокомпонента между расплавом и кристаллом происходит
- 16. Пример №1 Выделить изотоп актиния из продуктов распада тория методом сокристаллизации. 228Ac – бета активный изотоп.
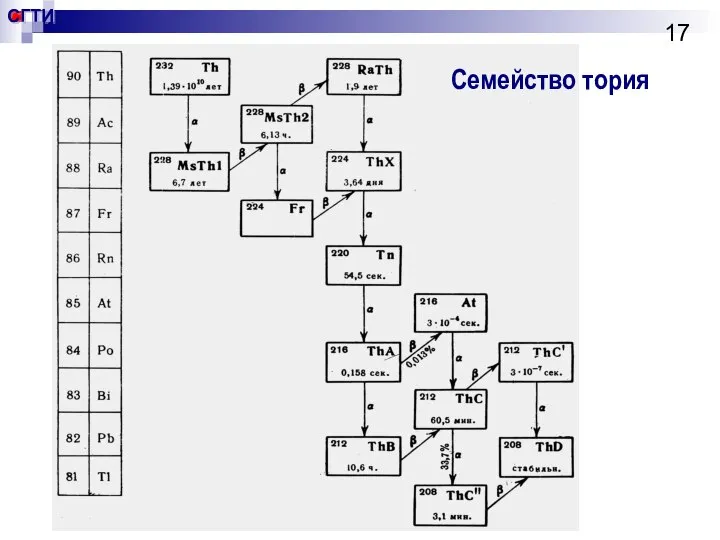
- 17. Семейство тория
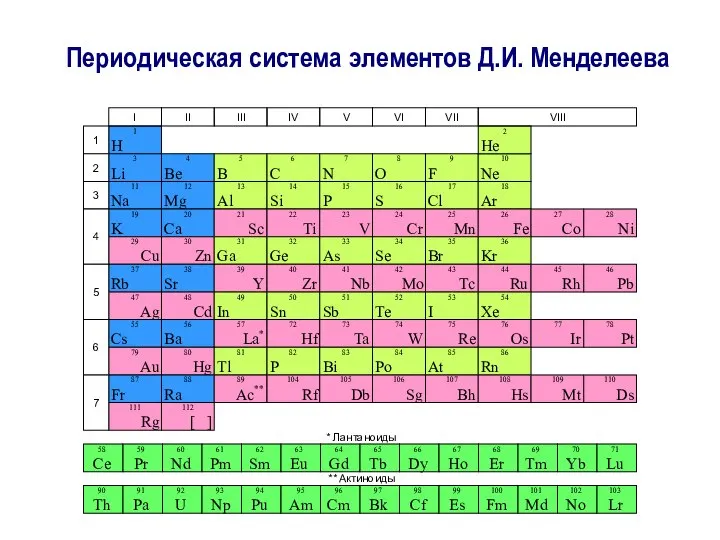
- 18. Периодическая система элементов Д.И. Менделеева
- 19. Выполнение разделения Сокристаллизация Ra и Pb c макрокомпонентами BaSO4 и PbSO4. 228Ra2+ +BaCl2 + Na2SO4 =
- 20. АДСОРБЦИЯ Этот процесс на практике используется для глубокой очистки растворов от радиоактивных элементов, но адсорбция может
- 21. Фрейндлиха: х и у - равновесные концентрации сорбируемого вещества в сорбенте и в растворе; А и
- 22. АДСОРБЦИЯ Адсорбция ионов на полярных кристаллах Механизм обмена на полярных кристаллах связан с образованием двойного электрического
- 23. I – кристалл ; II – внутренняя часть двойного слоя (потенциал определяющая адсорбция); III – внутренняя
- 24. Адсорбция на гидроксидах и углях Адсорбция на гидроксидах многовалентных металлов отлична от адсорбции на кристаллах непостоянством
- 25. Пример №2 Выделить изотоп 234Th из дочерних продуктов распада 238U методом адсорбции на гидроксиде железа. Радиоактивный
- 26. Концентрация Th в растворе меньше 1·10-9 моль/л и поэтому Th не может образовать самостоятельную твердую фазу
- 27. ИОНООБМЕННОЕ РАЗДЕЛЕНИЕ РАДИОНУКЛИДОВ Метод разделения основан на различии в устойчивости связей сорбируемого иона с ионитом. Иониты
- 29. Классификация ионитов по Никольскому Рис. 1 – Зависимость обменной емкости от рН раствора По степени диссоциации
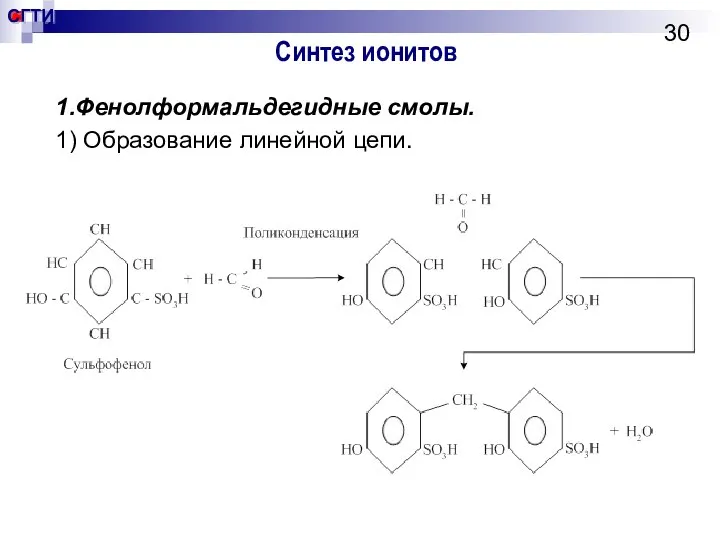
- 30. Синтез ионитов 1.Фенолформальдегидные смолы. 1) Образование линейной цепи.
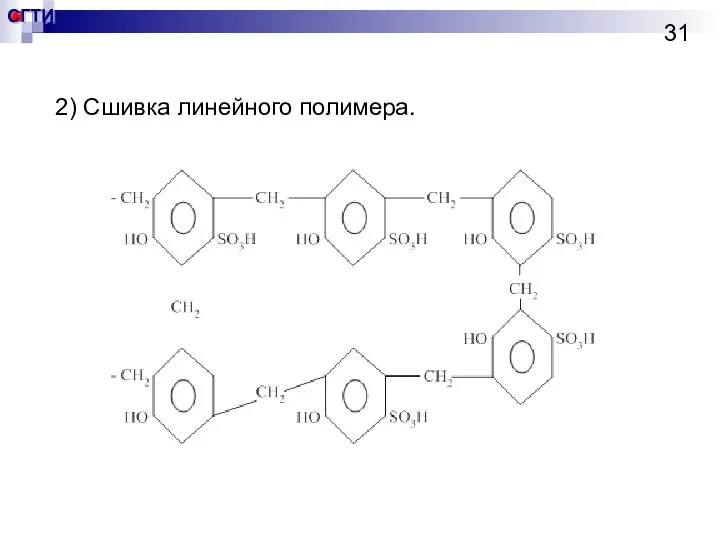
- 31. 2) Сшивка линейного полимера.
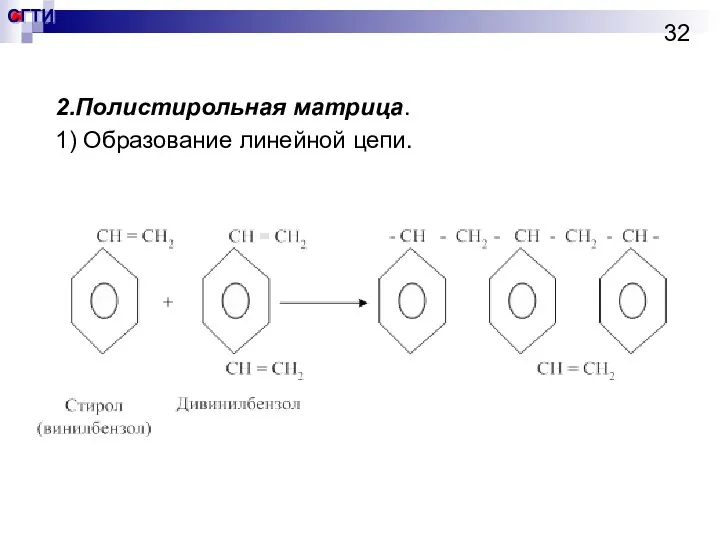
- 32. 2.Полистирольная матрица. 1) Образование линейной цепи.
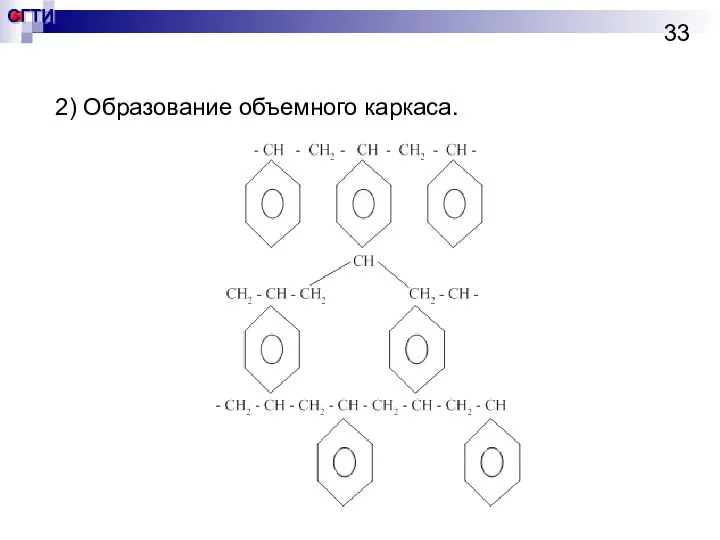
- 33. 2) Образование объемного каркаса.
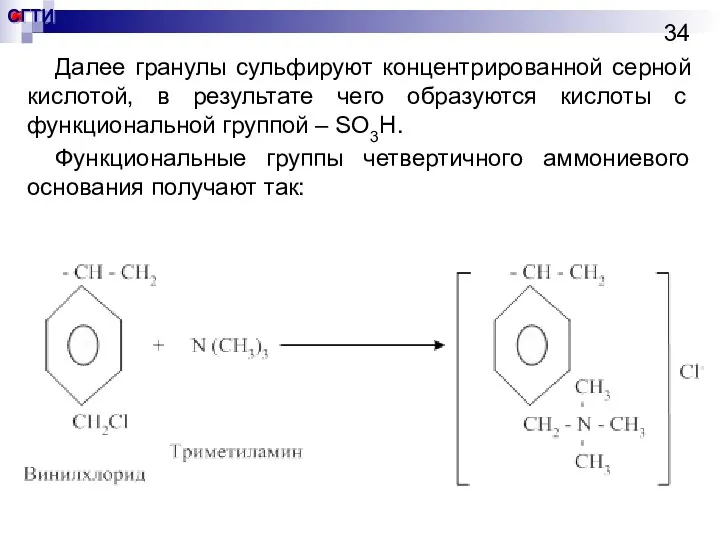
- 34. Далее гранулы сульфируют концентрированной серной кислотой, в результате чего образуются кислоты с функциональной группой – SO3H.
- 35. Основные характеристики ионообменных смол: 1) марка (АВ 17-8 - анионит высокоосновный, №17, 8% дивинилбензола; КБ –
- 36. Равновесие ионного обмена Катионный обмен Константа ионного обмена: Уточненная концентрационная константа ионного обмена:
- 37. Повысить извлечение катиона металла из раствора можно путем контроля за рН раствора. Константа обмена, как правило,
- 38. Анионный обмен Переведем анионит в Сl-форму:
- 39. С ростом хлорид-ионов в растворе концентрация комплексного иона в растворе растет и при концентрации соляной кислоты
- 40. Селективность ионного обмена Селективность ионного обмена определяется двумя факторами: 1) валентностью и радиусом обменивающихся ионов в
- 41. Кинетика ионного обмена Внешнедиффузионная область где К - константа скорости; - концентрация сорбируемого иона в растворе;
- 42. Внутренняя диффузия где R - радиус зерна ионита; - концентрация иона в насыщенном сорбенте; - концентрация
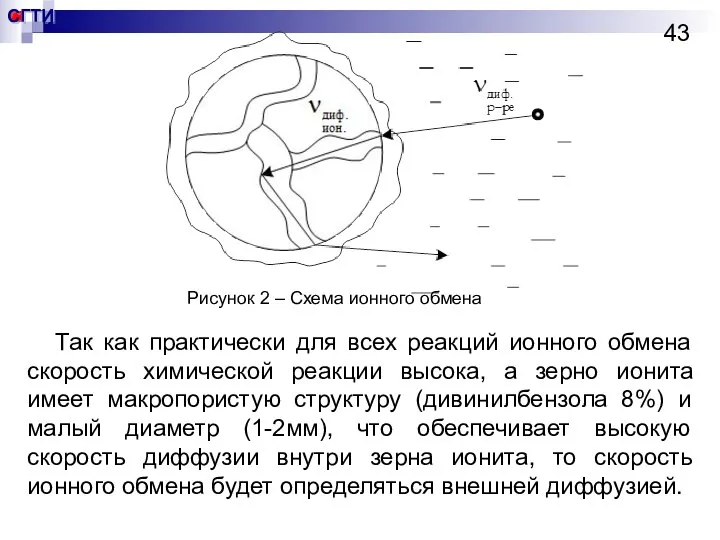
- 43. Так как практически для всех реакций ионного обмена скорость химической реакции высока, а зерно ионита имеет
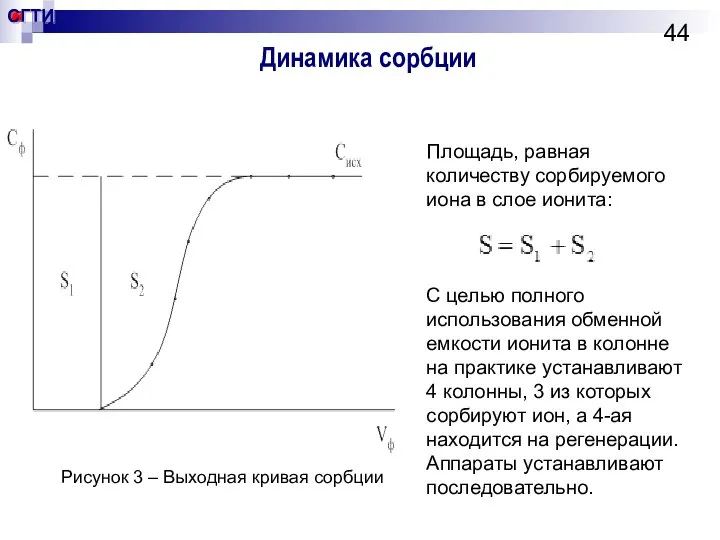
- 44. Динамика сорбции Площадь, равная количеству сорбируемого иона в слое ионита: С целью полного использования обменной емкости
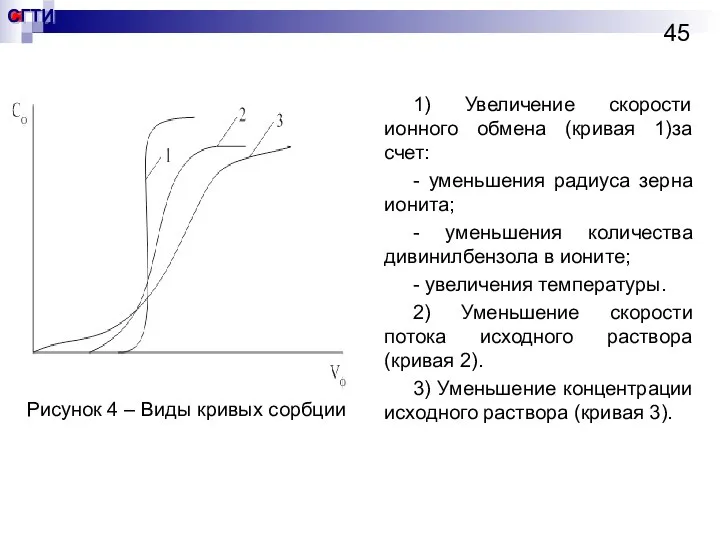
- 45. 1) Увеличение скорости ионного обмена (кривая 1)за счет: - уменьшения радиуса зерна ионита; - уменьшения количества
- 46. Пример №3 Разделение 23892U и 23490Тh на анионите АВ-17х8 Разделение 23892U и 23490Тh основано на различии
- 48. Скачать презентацию


































 Основы химической термодинамики
Основы химической термодинамики Проверочные работы по темам: Неметаллы. 9 класс
Проверочные работы по темам: Неметаллы. 9 класс Полимеры
Полимеры Анализ объектов окружающей среды. Сопоставление и выбор методов анализа
Анализ объектов окружающей среды. Сопоставление и выбор методов анализа Group 6 Cations
Group 6 Cations Задачи. Периодическая система. Строение атома. Повторение
Задачи. Периодическая система. Строение атома. Повторение Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Металлы в природе. Общие способы их получения
Металлы в природе. Общие способы их получения Template biosynthesis
Template biosynthesis Адсорбция твёрдыми адсорбентами
Адсорбция твёрдыми адсорбентами Кислород. Оксиды. Валентность
Кислород. Оксиды. Валентность Оксиды, получение и свойства
Оксиды, получение и свойства Предмет органической химии. Особенности органических веществ
Предмет органической химии. Особенности органических веществ Химическое равновесие. Принцип Ле Шателье
Химическое равновесие. Принцип Ле Шателье Химическая связь
Химическая связь Выращивание кристаллов
Выращивание кристаллов Наука химия. Интеллектуальная игра. 5-8 класс
Наука химия. Интеллектуальная игра. 5-8 класс Алкилкарбон қышқылдарының тұздарын алу
Алкилкарбон қышқылдарының тұздарын алу Использование элементов модульной технологии на уроках химии
Использование элементов модульной технологии на уроках химии Комплексные соединения
Комплексные соединения Изучение фотокатализа в химии
Изучение фотокатализа в химии Строение и функции отдельных коферментов
Строение и функции отдельных коферментов Опасные химические вещества
Опасные химические вещества Наша стирка по-байкальски. Синтетические моющие средства (СМС¸ детергенты)
Наша стирка по-байкальски. Синтетические моющие средства (СМС¸ детергенты) Кремний и его соединения
Кремний и его соединения Реакции замещения
Реакции замещения Реакции
Реакции Презентация Лекция 1. Химическая термодинамика
Презентация Лекция 1. Химическая термодинамика