Содержание
- 2. 08/21/2023 Годы жизни Родился в Париже 8 октября 1850 года Умер 17 сентября 1936 Его отец,
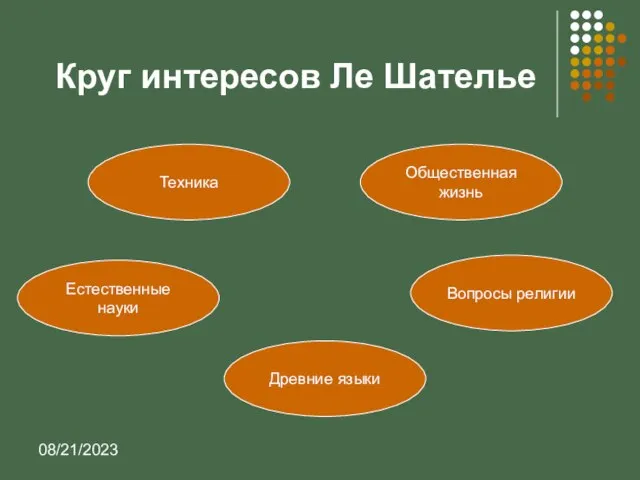
- 3. 08/21/2023 Круг интересов Ле Шателье Техника Естественные науки Древние языки Вопросы религии Общественная жизнь
- 4. 08/21/2023 Преподавательская деятельность С 1877 по 1919г. профессор Парижской Высшей горной школы, где преподавал общую и
- 5. 08/21/2023 Научная деятельность При активном участии Ле Шателье физическая химия и химическая технология превратились в самостоятельные,
- 6. 08/21/2023 1880г Ле Шателье занимался проблемой обжига и затвердевания цемента; имевшиеся к тому времени исследования не
- 7. 08/21/2023 Колба Ле Шателье. Для определения удельного веса гидравлического цемента и извести
- 8. 08/21/2023 Кольцо Ле Шателье Для определения равномерности изменения объема цемента и гашеной извести.
- 9. 08/21/2023 1881г Совместно с М. Бертло и Ф. Малларом он занялся исследованиям процессов воспламенения, горения и
- 10. 08/21/2023 1884 Сформулировал общий закон смещения химического равновесия в зависимости от внешних факторов: Внешнее воздействие, которое
- 11. 08/21/2023 Принцип Ле Шателье если на систему, находящуюся в равновесии, оказывается внешнее воздействие (изменяется концентрация, температура,
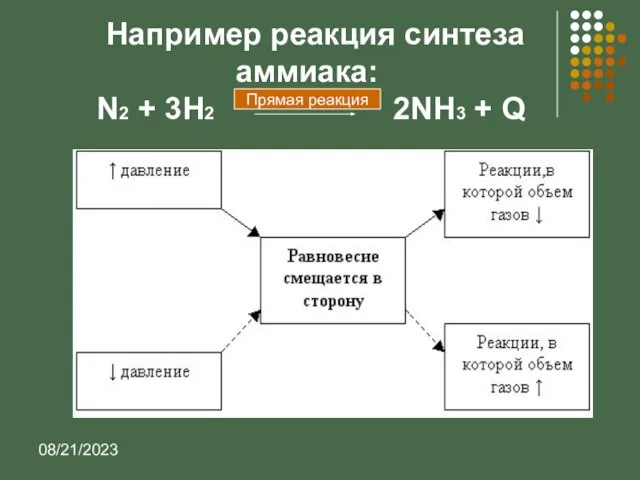
- 12. 08/21/2023 Например реакция синтеза аммиака: N2 + 3H2 2NH3 + Q Прямая реакция
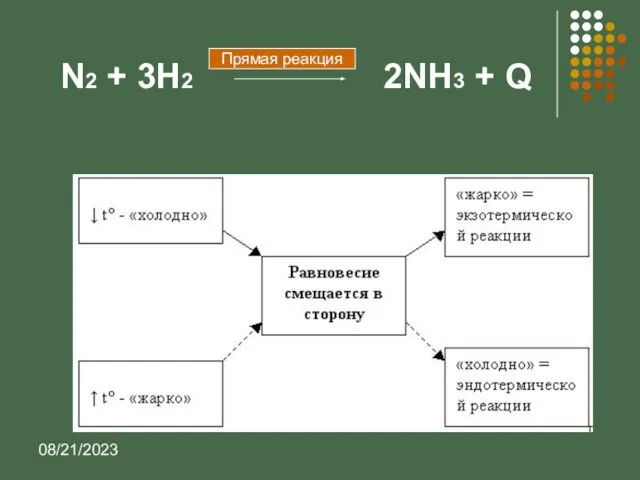
- 13. 08/21/2023 N2 + 3H2 2NH3 + Q Прямая реакция
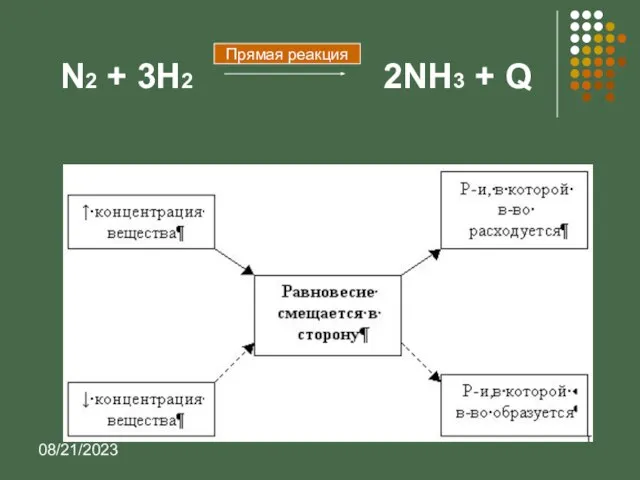
- 14. 08/21/2023 N2 + 3H2 2NH3 + Q Прямая реакция
- 15. 08/21/2023 Выводы: При повышении концентрации реагирующих веществ равновесие смещается в сторону образования продуктов; При повышении концентрации
- 16. 08/21/2023 1886г Разработал пирометр – оптический прибор, измеряющий температуру раскалённых тел по их цвету. Усовершенствовал методику
- 17. 08/21/2023 1897 Создал металлографический микроскоп , с помощью которого можно было изучать строение непрозрачных объектов. Современный
- 18. 08/21/2023 1894г Вывел уравнение, устанавливающие зависимость между растворимостью, температурой процесса и теплотой плавления вещества. Независимо от
- 19. 08/21/2023 Награды: в 1886г кавалер ордена Почётного легиона 1916г. медаль Дэви Лондонского королевского общества
- 21. Скачать презентацию














 Сложные эфиры. Жиры
Сложные эфиры. Жиры Взаимодействие цинка с разбавленной соляной кислотой. Лабораторный опыт. Шаблон
Взаимодействие цинка с разбавленной соляной кислотой. Лабораторный опыт. Шаблон Получение азокрасителя в лабораторных условиях
Получение азокрасителя в лабораторных условиях Образование химических соединений с учетом валентности элементов
Образование химических соединений с учетом валентности элементов Презентация на тему Азот
Презентация на тему Азот  Nanofibers of aluminum oxide
Nanofibers of aluminum oxide Презентация на тему Углекислый газ
Презентация на тему Углекислый газ  Полистирол. Оформление мини-реферата по химии
Полистирол. Оформление мини-реферата по химии Опасная бытовая химия!
Опасная бытовая химия! Химическая организация природы
Химическая организация природы Кислород
Кислород Сследование коэффициентов переноса жидкостей в молекулярных моделях opls и saft
Сследование коэффициентов переноса жидкостей в молекулярных моделях opls и saft Три секрета прочности волокнистых композитов
Три секрета прочности волокнистых композитов Активность каталазы
Активность каталазы Оливины. Структура оливинов
Оливины. Структура оливинов Разбор ДЗ. Титрование – общие моменты
Разбор ДЗ. Титрование – общие моменты Аналитическая химия как наука. Лекция 1
Аналитическая химия как наука. Лекция 1 Перманганатометрия и комплексонометрия
Перманганатометрия и комплексонометрия Органическая химия. Химические свойства и типы реакций. (9 класс)
Органическая химия. Химические свойства и типы реакций. (9 класс) Какую воду мы пьем
Какую воду мы пьем Кислоты
Кислоты Качественная реакция на многоатомные спирты
Качественная реакция на многоатомные спирты Электролитическая диссоциация
Электролитическая диссоциация Сказка о братьях карбонатах
Сказка о братьях карбонатах Теоретические основы каталитических процессов переработки нефтегазового сырья. Тема 6
Теоретические основы каталитических процессов переработки нефтегазового сырья. Тема 6 Природные источники углеводородов
Природные источники углеводородов Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Презентация на тему Многоатомные спирты
Презентация на тему Многоатомные спирты