Содержание
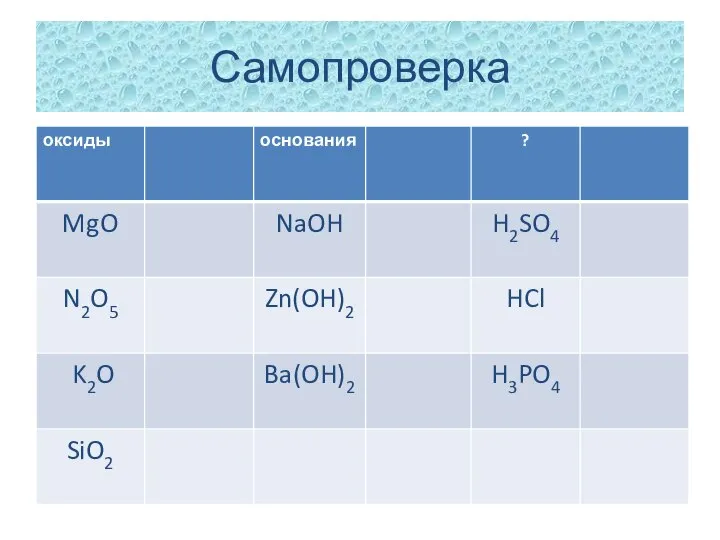
- 2. Самопроверка
- 3. Перед вами предметы из рюкзака туриста. Какое вещество объединяет их?
- 4. Кислоты Лакмус будет в них краснеть, Растворяться – цинк и медь. А мелок в них, посмотри,
- 5. Содержание 1). Определение. Формулы кислот. 2). Классификация кислот. 3). Физические свойства. 4). Химические свойства. 5). Техника
- 6. Определение. Формулы кислот. Кислотами называются сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металлов
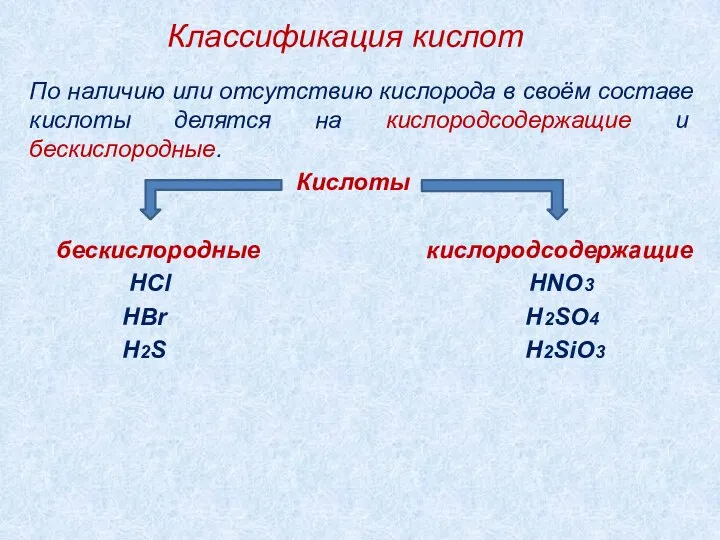
- 7. Классификация кислот По наличию или отсутствию кислорода в своём составе кислоты делятся на кислородсодержащие и бескислородные.
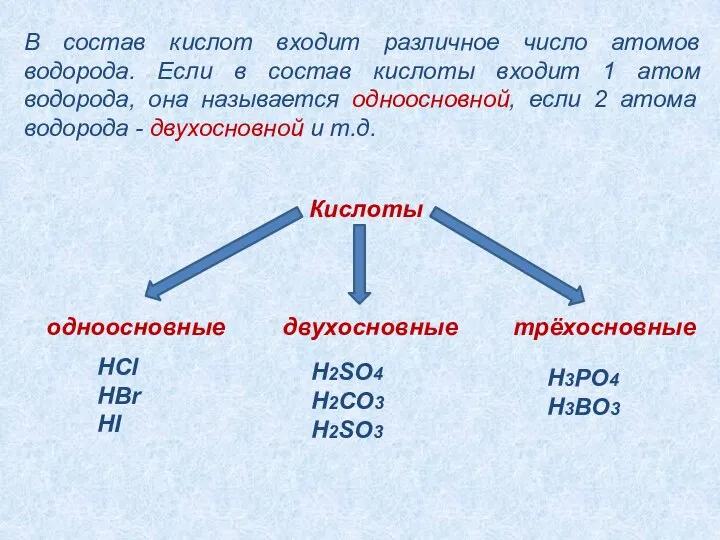
- 8. В состав кислот входит различное число атомов водорода. Если в состав кислоты входит 1 атом водорода,
- 9. Физические свойства Многие кислоты – это бесцветные жидкости, например серная H2SO4, соляная HCl, азотная HNO3. Известны
- 10. Химические свойства 1). Действие кислот на растворы индикаторов. (от латинского indicator – указатель) Вещества, которые под
- 11. Техника безопасности при работе с кислотами 1). Кислоты нельзя пробовать на вкус, т.к. они вызывают ожоги
- 12. 7). При отравлении кислотой: выпить 5-6 стаканов тёплой воды и вызвать рвоту, затем выпить столько же
- 13. Дайте характеристику следующим кислотам HCl, HNO3, H2SO3 по плану: 1.наличие кислорода 2.основность 3.растворимость 4.степени окисления элементов,
- 14. Вопросы для повторения 1). Сложное вещество, состоящее из атома водорода и кислотного остатка называется – 2).
- 15. Рефлексия Решены ли нами учебные задачи, поставленные в начале урока? - Какие способы решения учебных задач
- 16. СПАСИБО ЗА УРОК
- 18. Скачать презентацию












 Причины протекания химических реакций
Причины протекания химических реакций Сeквенирование нуклеиновых кислот
Сeквенирование нуклеиновых кислот Строение атома
Строение атома Общая характеристика галогенов на основе положения химических элементов в периодической системе
Общая характеристика галогенов на основе положения химических элементов в периодической системе Занимательная химия в 8 классе
Занимательная химия в 8 классе Взаимное притяжение и отталкивание молекул
Взаимное притяжение и отталкивание молекул Разбор задач
Разбор задач Физико-химические свойства растворов ВМС
Физико-химические свойства растворов ВМС Коррозия металлов
Коррозия металлов Арены. Ароматические углеводороды
Арены. Ароматические углеводороды Презентация на тему Углекислый газ CO2
Презентация на тему Углекислый газ CO2  Карбонильные соединения
Карбонильные соединения Электронная структура атомов
Электронная структура атомов Интеллектуальные игры. Химия
Интеллектуальные игры. Химия Липиды
Липиды Нуклеирующие добавки
Нуклеирующие добавки Оценивание эффективности многофункциональной присадки для бензинов
Оценивание эффективности многофункциональной присадки для бензинов Коррозия. способы защиты от коррозии
Коррозия. способы защиты от коррозии Алгебраический метод решения задач В-9 – элемент решения задач С4
Алгебраический метод решения задач В-9 – элемент решения задач С4 Современные подходы к преподаванию химии
Современные подходы к преподаванию химии Решение экспериментальных задач по теме Основные классы неорганических соединений. Практическая работа № 4
Решение экспериментальных задач по теме Основные классы неорганических соединений. Практическая работа № 4 Понятие о высокомолекулярных соединениях. Классификация пластмасс. Синтетические каучуки. Синтетические волокна. Капрон
Понятие о высокомолекулярных соединениях. Классификация пластмасс. Синтетические каучуки. Синтетические волокна. Капрон Растворы. Лекция №4
Растворы. Лекция №4 ОГЭ ХИМИЯ 1
ОГЭ ХИМИЯ 1 Презентация по Химии "Здоровьесберегающие технологии при изучении химии"
Презентация по Химии "Здоровьесберегающие технологии при изучении химии"  Презентация на тему Лабораторное оборудование. Посуда и средства защиты
Презентация на тему Лабораторное оборудование. Посуда и средства защиты  Ионные реакции
Ионные реакции Полезные ископаемые
Полезные ископаемые