Содержание
- 2. Домашнее задание: Смешали 30 г 15% раствора хлорида калия и 50 г 10% раствора хлорида калия.
- 3. Способность проводить электрический ток — одна из важнейших характеристик растворов веществ. Что такое электрический ток?
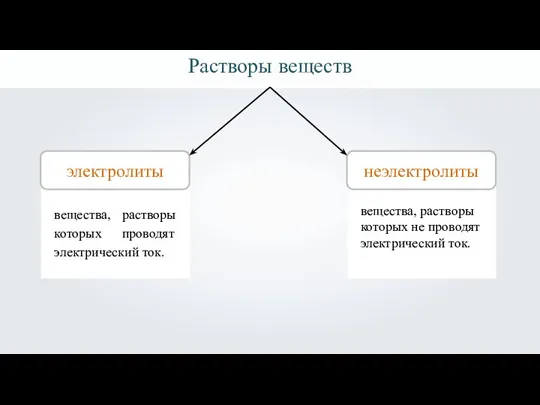
- 4. Растворы веществ электролиты 1 неэлектролиты вещества, растворы которых проводят электрический ток. вещества, растворы которых не проводят
- 5. Электролитическая диссоциация — процесс распада электролита на ионы.
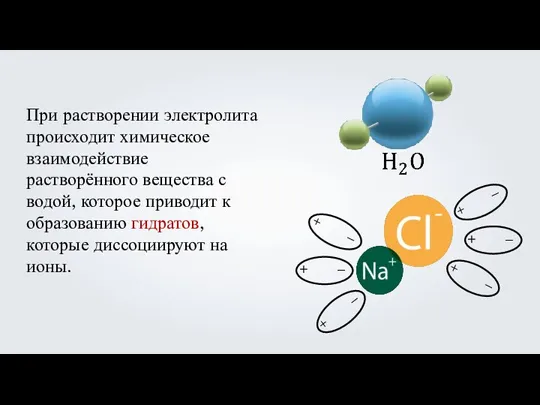
- 6. При растворении электролита происходит химическое взаимодействие растворённого вещества с водой, которое приводит к образованию гидратов, которые
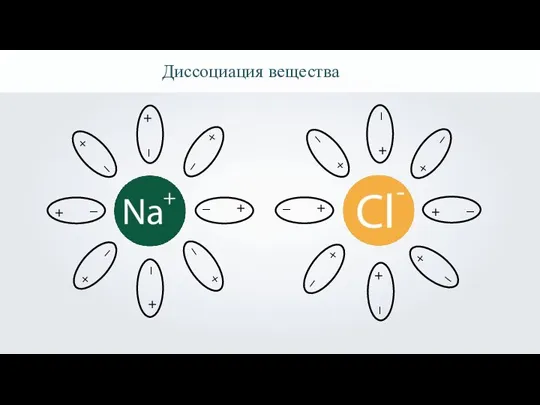
- 7. Диссоциация вещества
- 8. Диссоциация вещества
- 9. Процессы при диссоциации веществ в воде 1. Ориентация двухполярных молекул воды около ионов кристалла. 2. Взаимодействие
- 10. Ассоциация — процесс, при котором хаотически движущиеся гидратированные ионы могут столкнуться и объединиться.
- 11. При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы. Основные положения теории электролитической
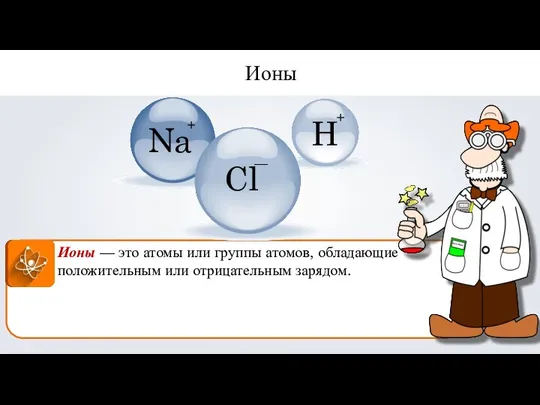
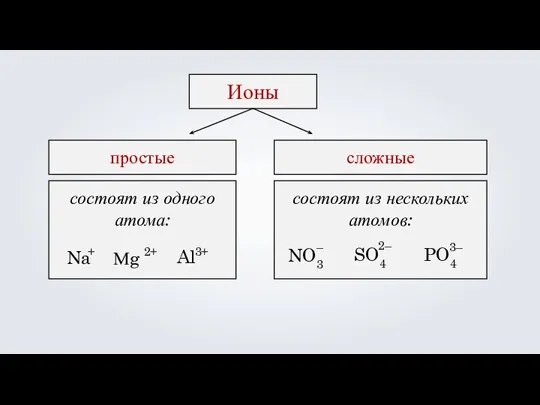
- 12. Ионы — это атомы или группы атомов, обладающие положительным или отрицательным зарядом. Ионы
- 13. состоят из одного атома: Ионы простые сложные состоят из нескольких атомов:
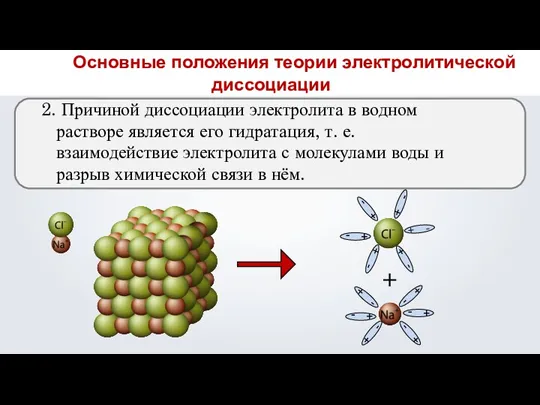
- 14. 2. Причиной диссоциации электролита в водном растворе является его гидратация, т. е. взаимодействие электролита с молекулами
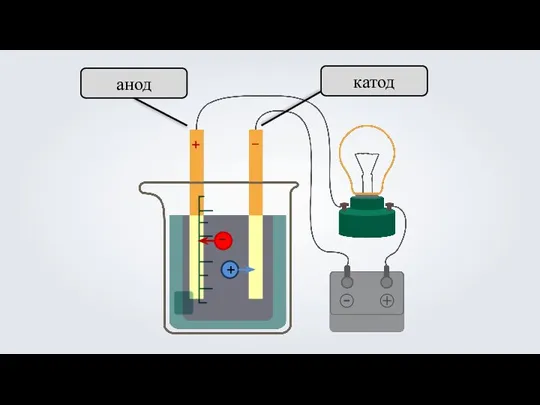
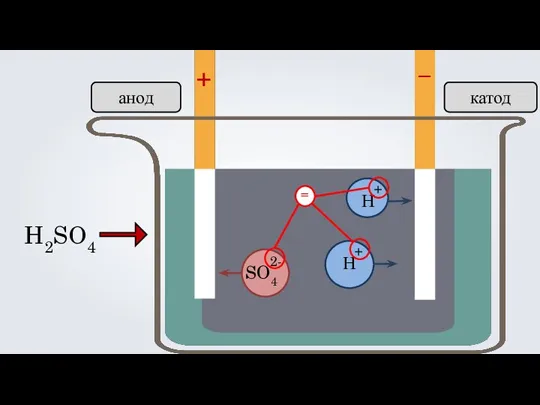
- 15. 3. Под действием электрического тока, положительно заряженные ионы движутся к отрицательно заряженному полюсу источника тока —
- 16. анод катод + –
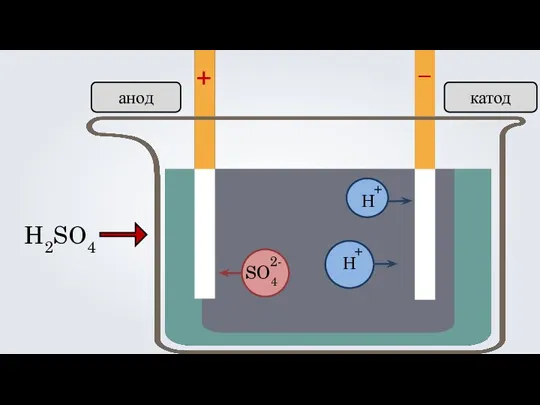
- 17. + – H2SO4 Н Н анод катод SO4 + + 2-
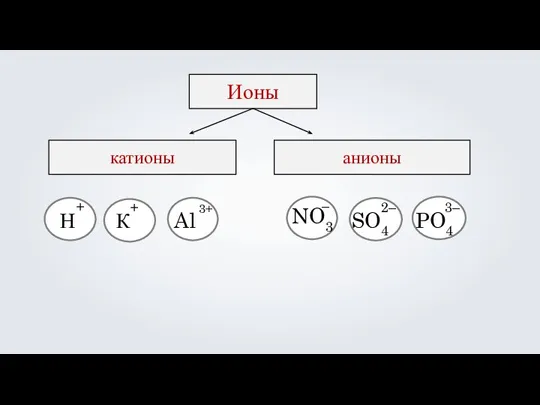
- 18. Ионы катионы анионы Н К Al NO3 – SO4 2– PO4 3– + + 3+
- 19. + – H2SO4 Н Н анод катод SO4 + + 2- =
- 20. 4. Электролитическая диссоциация — процесс обратимый для слабых электролитов. Н2СО3 2Н + СО3 + 2- Основные
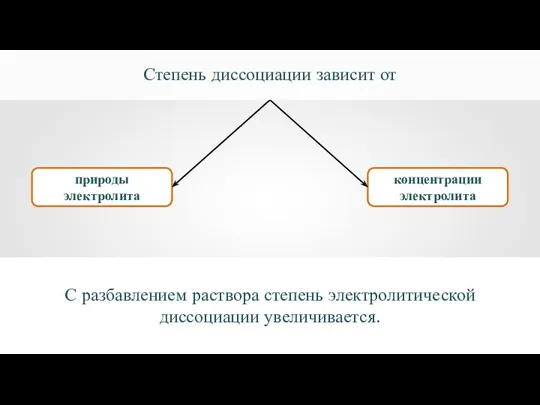
- 21. Степень диссоциации (α) — это отношение количества вещества электролита, распавшегося на ионы (nД), к общему количеству
- 22. природы электролита концентрации электролита Степень диссоциации зависит от С разбавлением раствора степень электролитической диссоциации увеличивается.
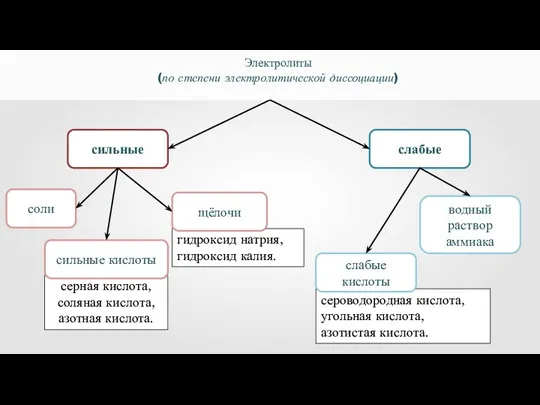
- 23. сильные слабые Электролиты (по степени электролитической диссоциации) соли гидроксид натрия, гидроксид калия. щёлочи водный раствор аммиака
- 32. Скачать презентацию
















 Кислородосодержащие органические вещества
Кислородосодержащие органические вещества Менделеевский период
Менделеевский период Презентация на тему Угольная и кремниевая кислоты и их соли
Презентация на тему Угольная и кремниевая кислоты и их соли  Химические свойства воды
Химические свойства воды Практика по химии
Практика по химии Бензол
Бензол Химия в быту
Химия в быту Биологически важные реакции монофункциональных соединений. Реакционная способность альдегидов, кетонов, карбоновых кислот
Биологически важные реакции монофункциональных соединений. Реакционная способность альдегидов, кетонов, карбоновых кислот Окислительно- восстановительные реакции в органической химии. Подготовка к ЕГЭ
Окислительно- восстановительные реакции в органической химии. Подготовка к ЕГЭ Алкены. Тестирование
Алкены. Тестирование Химическое ассорти
Химическое ассорти Водорастворимые витамины. 7 свойств водорастворимых витаминов
Водорастворимые витамины. 7 свойств водорастворимых витаминов Обобщение знаний об углеводородах
Обобщение знаний об углеводородах История развития органической химии
История развития органической химии Понятие фазы вещества. Насыщенный пар и его свойства. Влажность воздуха. Приборы для измерения влажности воздуха
Понятие фазы вещества. Насыщенный пар и его свойства. Влажность воздуха. Приборы для измерения влажности воздуха Презентация на тему Общая характеристика металлов главных подгрупп I-III
Презентация на тему Общая характеристика металлов главных подгрупп I-III  1_
1_ Коагуляция в дисперсных системах
Коагуляция в дисперсных системах Серная кислота
Серная кислота Переработка нефти. 10 класс
Переработка нефти. 10 класс Получение серной кислоты
Получение серной кислоты Альфа и бета распад. Правило смещения
Альфа и бета распад. Правило смещения Презентация на тему Углекислый газ
Презентация на тему Углекислый газ  Презентация на тему Химия и стирка
Презентация на тему Химия и стирка  Гипер-гипофосфатемия
Гипер-гипофосфатемия Оксиген та кисень
Оксиген та кисень Алициклические и гетероциклические соединения. Тема № 7, 8
Алициклические и гетероциклические соединения. Тема № 7, 8 Классы неорганических соединений (основания)
Классы неорганических соединений (основания)