Содержание
- 2. 1. История открытия галогенов 2. Положение в Периодической системе 3. Химические свойства 4. Применение 5.Проверка знаний
- 3. Фтор История открытия галогенов Хлор Бром Йод Астат
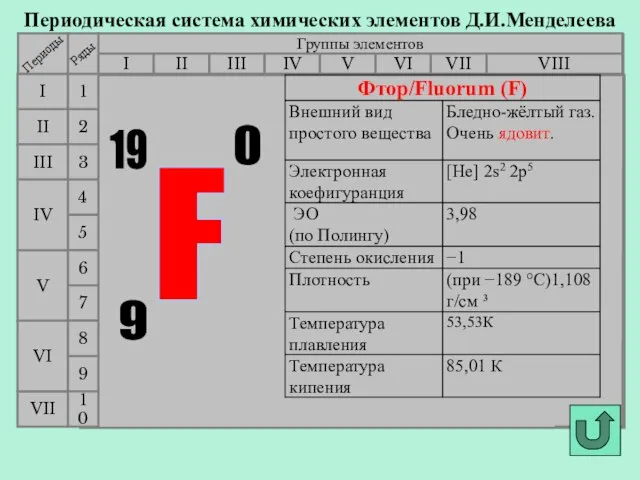
- 4. В 1886 году французский химик А. Муассан, используя электролиз жидкого фтороводорода, охлажденного до температуры –23°C (в
- 5. В 1774 году шведский ученый К. Шееле открыл хлор, который принял за сложное вещество и назвал
- 6. В 1825 году французский химик А.Ж.Балар при изучении маточных рассолов выделил темно-бурую жидкость, который он назвал
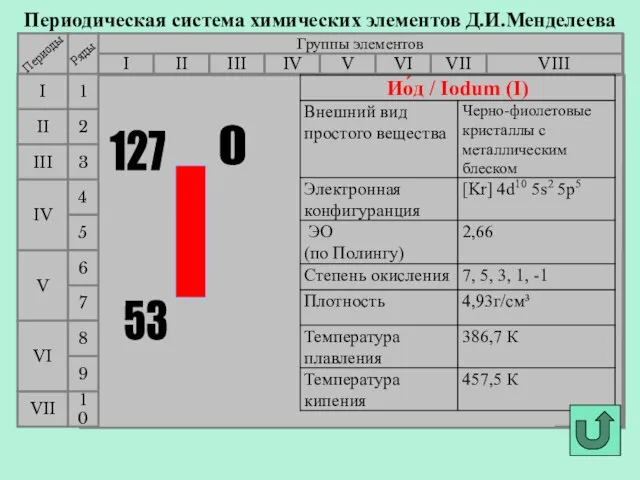
- 7. В 1811 году французский химик Бернар Куртуа открыл иод путём перегонки маточных растворов от своего азотнокислого
- 8. В 1869 г Д.И.Мендеелеев предсказал его существование и возможность открытия в будущем (как «эка-иод»). Впервые астат
- 9. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 10. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 11. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 12. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 13. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 14. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 15. Химические свойства 45 F2 -наиболее реакционноспособен , реакции идут на холоде, при нагревании – даже с
- 16. Химические свойства Cl2 - сильно реакционноспособен (искл. C, O2, N2 и некот. др.) С простыми веществами:
- 17. Химические свойства Br2 - реакционноспособен С простыми веществами: С металлами С неметаллами Al + Br2 →
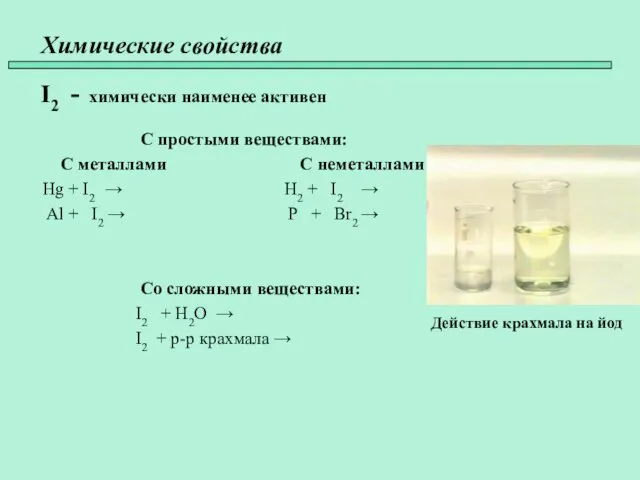
- 18. Химические свойства I2 - химически наименее активен С простыми веществами: С металлами С неметаллами Hg +
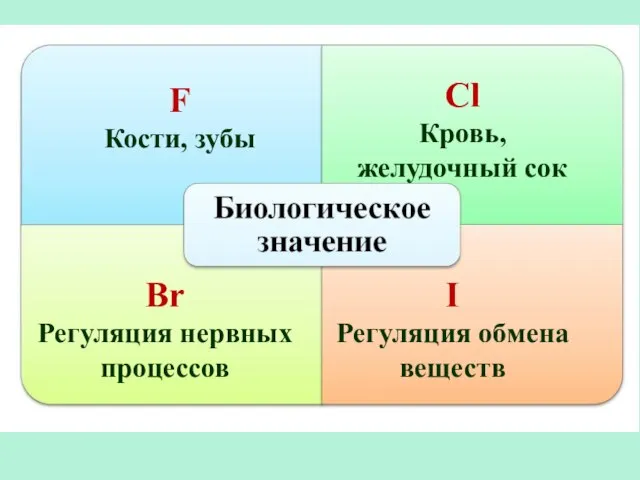
- 19. F Кости, зубы Сl Кровь, желудочный сок Br Регуляция нервных процессов I Регуляция обмена веществ
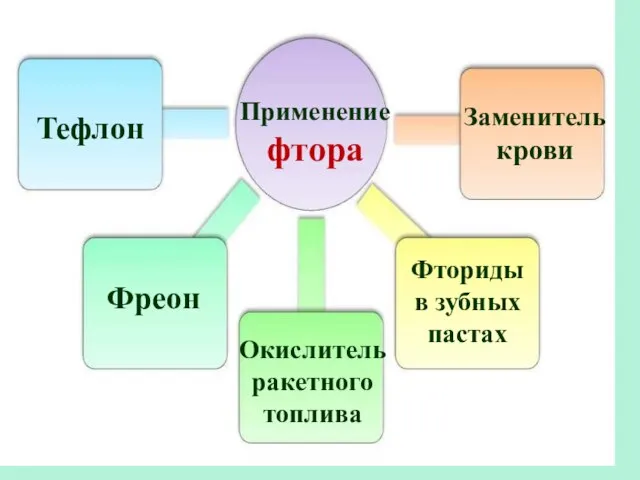
- 20. Применение фтора Тефлон Фреон Окислитель ракетного топлива Заменитель крови Фториды в зубных пастах
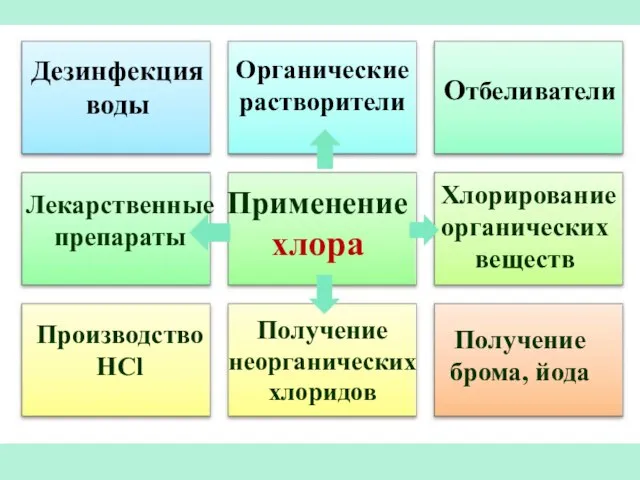
- 21. Применение хлора Отбеливатели Производство HCl Получение брома, йода Дезинфекция воды Органические растворители Лекарственные препараты Хлорирование органических
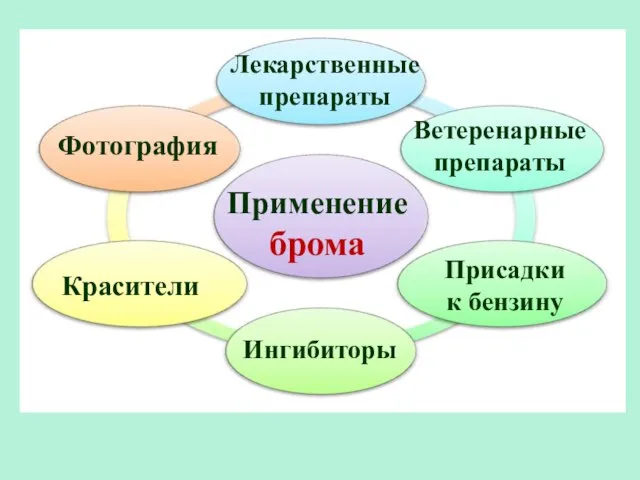
- 22. Применение брома Лекарственные препараты Красители Фотография Ветеренарные препараты Ингибиторы Присадки к бензину
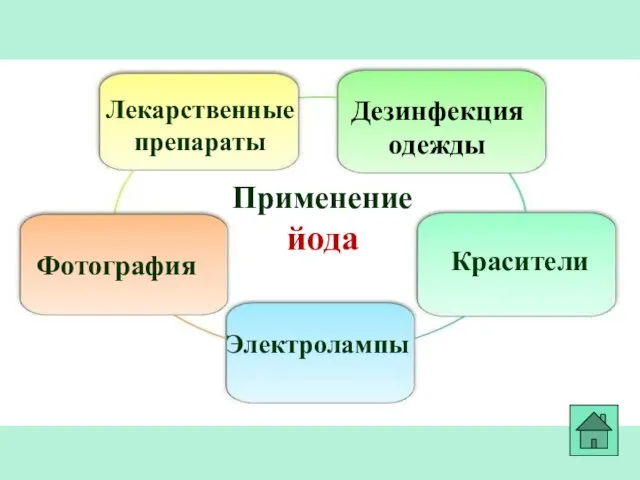
- 23. Применение йода Лекарственные препараты Фотография Красители Дезинфекция одежды Электролампы
- 24. Физические свойства галогенов Заполни пропуски Фтор - , в воде , так как интенсивно с ней
- 25. Химические свойства галогенов Поставь коэффициенты Na + Cl2 = NaCl S + F2 = SF6 Fe
- 26. Химические свойства галогенов Найди соответствие между исходными веществами и продуктами реакций Xe + 2F2 = H2
- 27. § 22, упр.4 Домашнее задание
- 28. Спасибо за урок! Благодарю за сотрудничество.
- 30. Скачать презентацию



















 Химическая связь
Химическая связь Основные понятия химической термодинамики
Основные понятия химической термодинамики Электрическая диссоциация
Электрическая диссоциация Использование национально-регионального компонента по химии для основной школы
Использование национально-регионального компонента по химии для основной школы Ионизирующее излучение и окружающая среда
Ионизирующее излучение и окружающая среда Презентация по Химии "Схема получения моноизотопного кремния"
Презентация по Химии "Схема получения моноизотопного кремния"  Относительная атомная масса. Массы атомов
Относительная атомная масса. Массы атомов Роль нитрадов. Взгляд специалистов
Роль нитрадов. Взгляд специалистов Спирты. Методы получения
Спирты. Методы получения Электролиз воды
Электролиз воды Электролитическая диссоциация веществ Реакции ионного обмена и условия их протекания
Электролитическая диссоциация веществ Реакции ионного обмена и условия их протекания Научно-исследовательская деятельность учащихся в процессе изучения химии
Научно-исследовательская деятельность учащихся в процессе изучения химии Соли. Классификация сложных веществ
Соли. Классификация сложных веществ Соли, их классификация и свойства
Соли, их классификация и свойства Строение вещества. Химическая связь и кристаллическое строение. Урок 1: Ионная и ковалентная связи
Строение вещества. Химическая связь и кристаллическое строение. Урок 1: Ионная и ковалентная связи Химические свойства алканов
Химические свойства алканов Композиционные материалы. Структура и свойства
Композиционные материалы. Структура и свойства Сплавы металлов
Сплавы металлов Современная аналитическая химия.Учебная литература
Современная аналитическая химия.Учебная литература Алкины. Строение
Алкины. Строение Химический анализ воды
Химический анализ воды Электролиз (катод)
Электролиз (катод) Способы получения чистых веществ в лаборатории
Способы получения чистых веществ в лаборатории Čo sú chemické reakcie
Čo sú chemické reakcie Теория химического строения органических веществ А.М. Бутлерова
Теория химического строения органических веществ А.М. Бутлерова Химические волокна. Урок 1-2
Химические волокна. Урок 1-2 Предмет органической химии
Предмет органической химии Разбор 25 задания. Вебинариум
Разбор 25 задания. Вебинариум