Содержание
- 2. ГибридизацияАО – это взаимодействие различных по форме, но близких по энергии АО, их смешивание и выравнивание
- 3. Причины гибридизации: Необходимость образования равноценных связей с другими атомами. Максимальное удаление атомов друг от друга в
- 4. Виды гибридизации
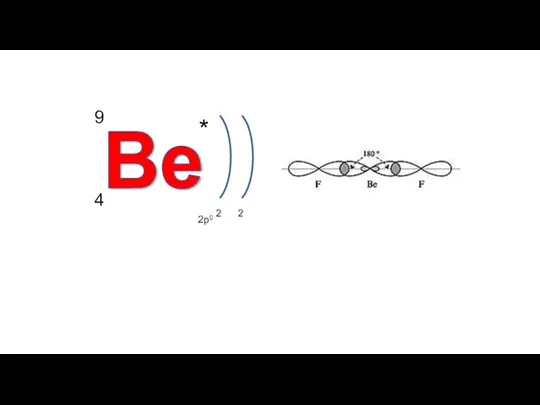
- 6. Типы гибридизаций: sp3- гибридизация
- 7. 1. Пространственная форма – тетраэдрическая Валентный угол – 109028/ Число связывающих электронных пар – 4 Число
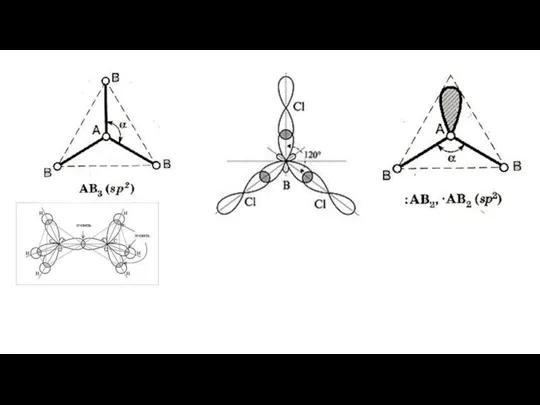
- 9. 1. Пространственная форма – плоскостной треугольник Валентный угол – 1200 Число связывающих электронных пар – 3
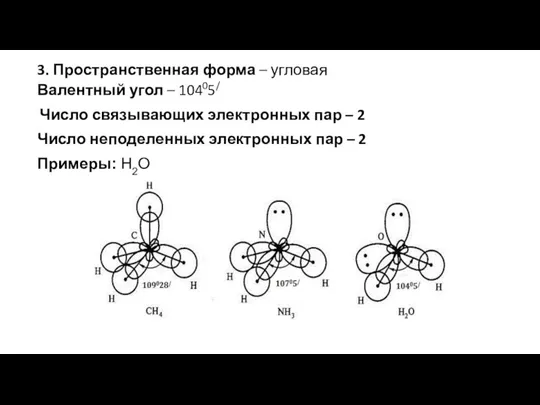
- 11. Пространственная форма – линейная Валентный угол – 1800 Число связывающих электронных пар – 2 Число неподеленных
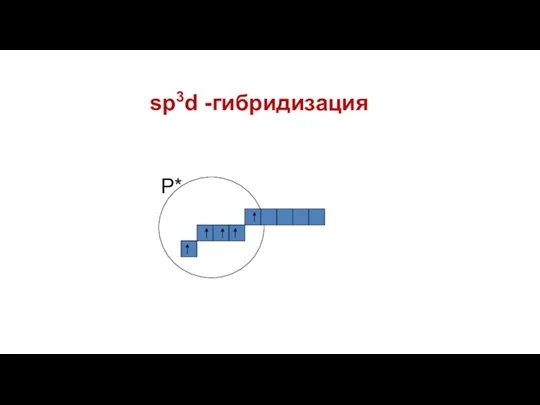
- 13. sp3d -гибридизация
- 14. Пространственная форма – тригонально-бипирамидальная Валентный угол – 90, 1200 Число связывающих электронных пар – 5 Число
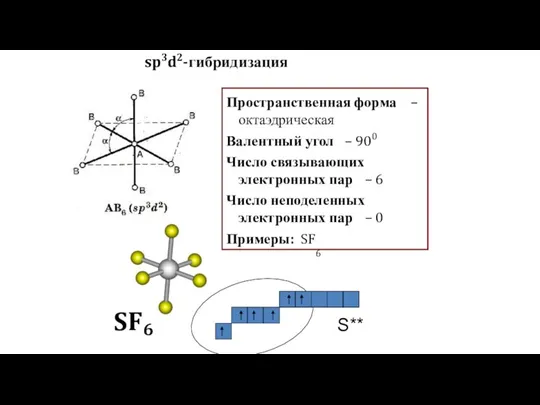
- 15. sp3d2-гибридизация
- 16. Алгоритм определения геометрии молекул: Определить число σ- связей для центрального атома Составить электронно-графическую схему валентных электронов
- 17. Выводы На форму молекул влияют: 1) тип гибридизации атомных орбиталей; 2) число атомов в молекуле. Если
- 19. Скачать презентацию











 Кристаллы. Виды
Кристаллы. Виды Общая характеристика криптона
Общая характеристика криптона Презентация на тему Химические свойства и применение алканов
Презентация на тему Химические свойства и применение алканов  Logo кроссворд первоначальные понятия. 8 класс
Logo кроссворд первоначальные понятия. 8 класс Химическая мозаика
Химическая мозаика Соединения галогенов
Соединения галогенов Начало репликации. Направление движения вилки репликации
Начало репликации. Направление движения вилки репликации Вещество. Свойства веществ
Вещество. Свойства веществ Электростанция в кармане
Электростанция в кармане Презентация по Химии "Анилин"
Презентация по Химии "Анилин"  Строение вещества
Строение вещества Алкадиены
Алкадиены Загрязнение почв пестицидами
Загрязнение почв пестицидами Строение вещества. Молекулы
Строение вещества. Молекулы Кислоты. 8 класс
Кислоты. 8 класс Превращения вещества
Превращения вещества Химия в косметологии
Химия в косметологии Плотность вещества
Плотность вещества Тяжелая вода
Тяжелая вода Взаимодействие с водой
Взаимодействие с водой Раздел 1
Раздел 1 Самородные металлы
Самородные металлы Алкены. Пентен- С5Н10
Алкены. Пентен- С5Н10 Презентация на тему Способы получения металлов
Презентация на тему Способы получения металлов  691614
691614 Курсовая работа: синтез n - бензил – n – этилэтанамина (диэтилбензиламина)
Курсовая работа: синтез n - бензил – n – этилэтанамина (диэтилбензиламина) Презентация Microsoft PowerPoint
Презентация Microsoft PowerPoint Теоретико-графовый анализ информативности кинетических параметров механизмов химических реакций
Теоретико-графовый анализ информативности кинетических параметров механизмов химических реакций