Содержание
- 2. Структура и классификация дисперсных систем Дисперсные системы (д.с.) - это гетерогенные системы, в которых одна из
- 3. Структура и классификация дисперсных систем В основе существующих классификаций лежат различные свойства д.с.: размер частиц дисперсной
- 4. Структура и классификация дисперсных систем Основной характеристикой д.с. и мерой раздробленности вещества является дисперсность: D =
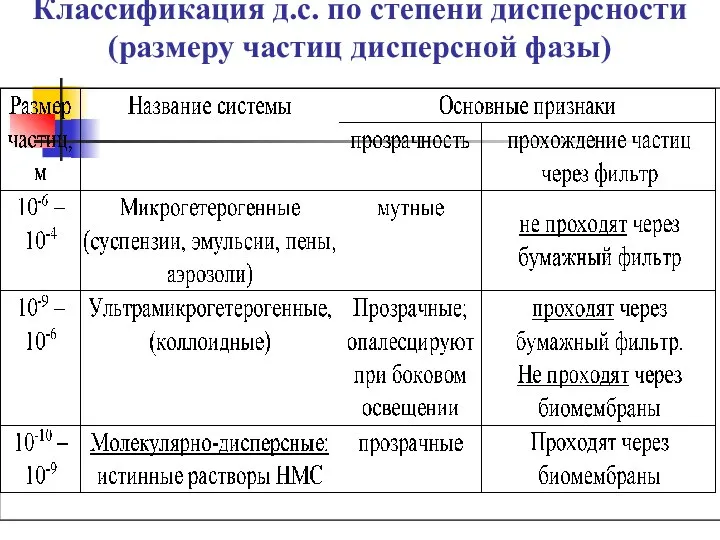
- 5. Классификация д.с. по степени дисперсности (размеру частиц дисперсной фазы)
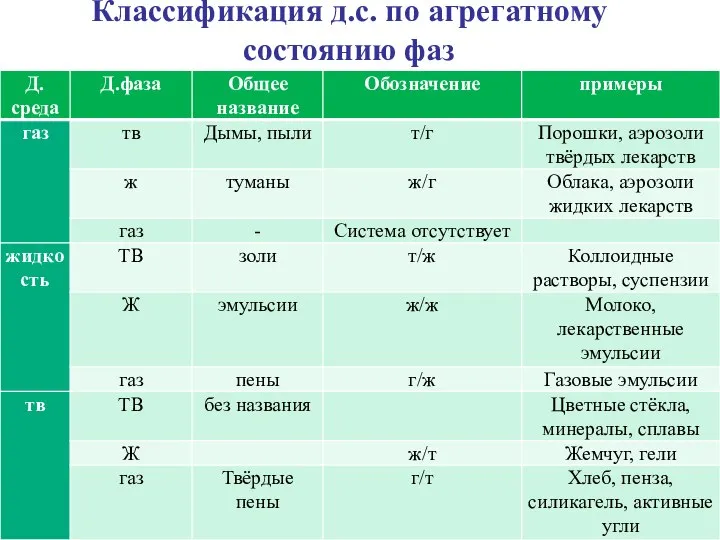
- 6. Классификация д.с. по агрегатному состоянию фаз
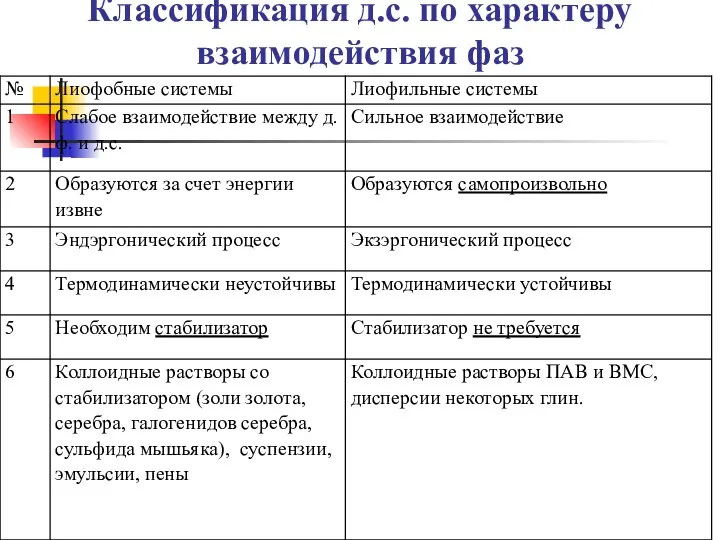
- 7. Классификация д.с. по характеру взаимодействия фаз
- 8. Классификация д.с. по структурно-механическим свойства
- 9. Термодинамика поверхностных явлений. Поверхностная энергия Гиббса и поверхностное натяжение Возникает на поверхности раздела фаз Силы, действующие
- 10. Поверхностная энергия Гиббса и поверхностное натяжение Для выхода молекул на поверхность требуется преодолеть избыточную энергию Гиббса.
- 11. Поверхностная энергия Гиббса и поверхностное натяжение Поверхностное натяжение – частная производная от энергии Гиббса по величине
- 12. Поверхностная энергия Гиббса и поверхностное натяжение Силовое выражение σ: это сила, действующая на поверхности по касательной
- 13. Поверхностная энергия Гиббса и поверхностное натяжение С ↑Т значение σ индивидуальных жидкостей на границе с воздухом
- 14. Поверхностная энергия Гиббса и поверхностное натяжение Поверхностное натяжение на границе раздела двух жидкостей – σж-ж подчиняется
- 15. Поверхностная энергия Гиббса и поверхностное натяжение Для систем ж-г, ж-ж σ определяется правилом П.А. Ребиндера: чем
- 17. Скачать презентацию











 Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Физические и химические явления 8 класс Учитель химии Кузнецова А.Н.
Физические и химические явления 8 класс Учитель химии Кузнецова А.Н. Индиго-краситель
Индиго-краситель Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН
Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН Химическая идентификация основных классов биомолекул
Химическая идентификация основных классов биомолекул Классификация спиртов
Классификация спиртов Презентация на тему ИКТ на уроках химии
Презентация на тему ИКТ на уроках химии  Базовые масла и присадки
Базовые масла и присадки Закон Гесса. Термохимические уравнения
Закон Гесса. Термохимические уравнения Ферменттер.Ферменттердің құрылымы.Биохимиялық маңызы
Ферменттер.Ферменттердің құрылымы.Биохимиялық маңызы Презентация на тему Алмаз, графит и фуллерен
Презентация на тему Алмаз, графит и фуллерен  Химические свойства классов неорганических соединений
Химические свойства классов неорганических соединений Disinfection without Chlorine and Chemistry
Disinfection without Chlorine and Chemistry Основания. 8 класс
Основания. 8 класс Сферы применения CaCO3
Сферы применения CaCO3 Алюминий. 9 класс
Алюминий. 9 класс Вебинар. Задачи из домашек по 27-29 задачам
Вебинар. Задачи из домашек по 27-29 задачам Алкины
Алкины Презентация на тему Ковалентная неполярная связь
Презентация на тему Ковалентная неполярная связь 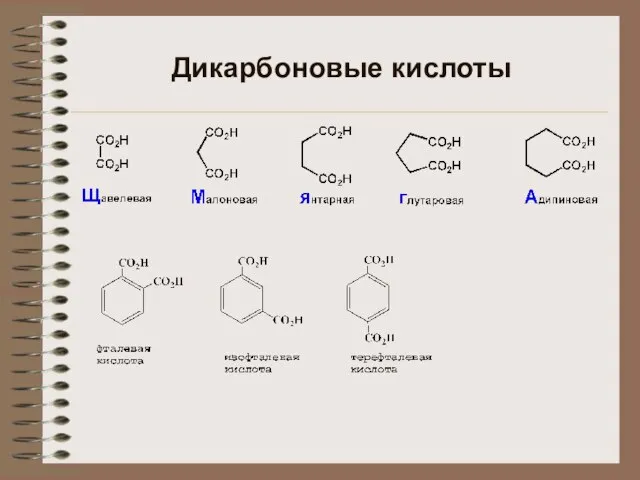 диовые кислоты
диовые кислоты Изучение микроклимата коровника с целью создания системы очистки воздуха от аммиака
Изучение микроклимата коровника с целью создания системы очистки воздуха от аммиака Железо как химический элемент
Железо как химический элемент 1-методы количественного анализа
1-методы количественного анализа Карбоновые кислоты
Карбоновые кислоты Лавка возможностей
Лавка возможностей Виды лабораторной посуды и её применение в исследовательской работе
Виды лабораторной посуды и её применение в исследовательской работе Калифорний Cf
Калифорний Cf Металлы d-элементы
Металлы d-элементы