Содержание
- 2. Принцип Ле-Шателье: если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (концентрация, температура, давление), то
- 3. При повышении температуры равновесие смещается в сторону эндотермической реакции (-Q), а при понижении температуры в сторону
- 4. При увеличении давления равновесие смещается в сторону меньших объемов, а при понижении давления в сторону больших
- 5. Условия смещения химического равновесия: 2. Давление (только для газообразных веществ) Например: Пример №2 СО2 (г) +
- 6. Чтобы сместить равновесие в сторону продуктов реакции (вправо), необходимо повысить концентрацию одного из исходных веществ (вступающих
- 8. Скачать презентацию





 Закон сохранения массы и энергии
Закон сохранения массы и энергии Азот
Азот Свойства ртути
Свойства ртути Теория электролитической диссоциации
Теория электролитической диссоциации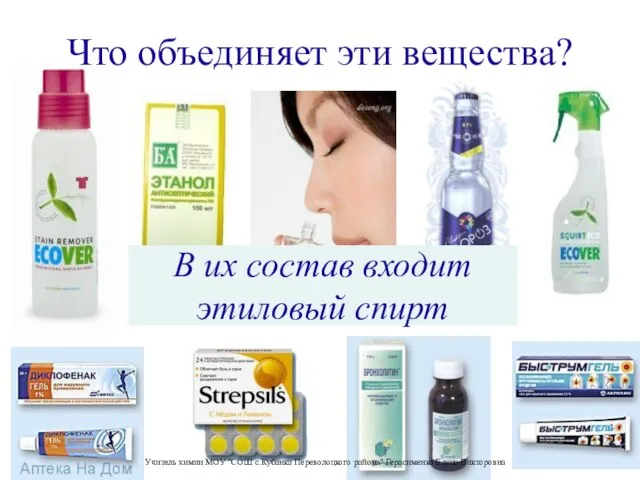 Презентация на тему Этиловый спирт и его влияние на организм человека
Презентация на тему Этиловый спирт и его влияние на организм человека  Идеальная химическая лаборатория в школе
Идеальная химическая лаборатория в школе Основные классы неорганических соединений
Основные классы неорганических соединений Металлы
Металлы Строение вещества. Химическая связь и кристаллическое строение. Урок 1: Ионная и ковалентная связи
Строение вещества. Химическая связь и кристаллическое строение. Урок 1: Ионная и ковалентная связи Коллоидно-химическая теория схватывания и твердения вяжущих веществ
Коллоидно-химическая теория схватывания и твердения вяжущих веществ Расчет псевдокритических свойств конденсатного газа и пластовых газоконденсатных жидкостей. Анализ рекомбинированных проб
Расчет псевдокритических свойств конденсатного газа и пластовых газоконденсатных жидкостей. Анализ рекомбинированных проб Презентация на тему Синтетические материалы
Презентация на тему Синтетические материалы  Алициклические и гетероциклические соединения. Тема № 7, 8
Алициклические и гетероциклические соединения. Тема № 7, 8 Химиялық қоспалар
Химиялық қоспалар Лекции_ ОБМЕН ЛИПИДОВ
Лекции_ ОБМЕН ЛИПИДОВ кремний и его соединения
кремний и его соединения Строение электронных оболочек атомов. 8 класс
Строение электронных оболочек атомов. 8 класс Получение карбоновых кислот
Получение карбоновых кислот Авиационное материаловедение. Лекция №1: Введение. Теория сплавов
Авиационное материаловедение. Лекция №1: Введение. Теория сплавов Типичные реакции кислот
Типичные реакции кислот Карбид кремния
Карбид кремния Степень окисления. Составление химических формул бинарных соединений
Степень окисления. Составление химических формул бинарных соединений Изомерия. Классификация органических веществ
Изомерия. Классификация органических веществ Предельные углеводороды. Урок №4
Предельные углеводороды. Урок №4 Составление химических формул методом нулевой суммы
Составление химических формул методом нулевой суммы Типы химических реакций в органической и неорганической химии
Типы химических реакций в органической и неорганической химии Образование химических соединений с учетом валентности элементов
Образование химических соединений с учетом валентности элементов Презентация на тему Неорганические и органические основания
Презентация на тему Неорганические и органические основания