Содержание
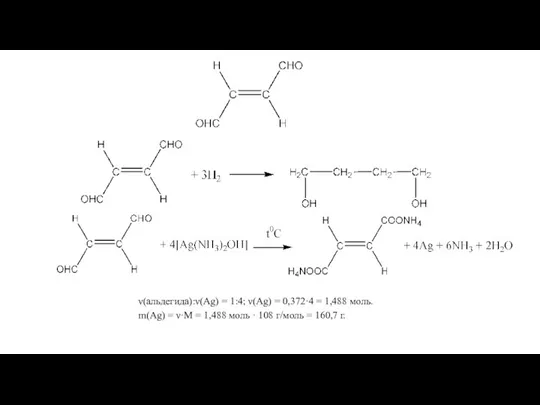
- 2. ν(альдегида):ν(Ag) = 1:4; ν(Ag) = 0,372·4 = 1,488 моль. m(Ag) = ν·M = 1,488 моль ·
- 3. В результате сгорания азотсодержащего гетероцикла объем полученной газовой смеси составил 6,16 л (н.у.). Относительная плотность полученной
- 4. Решая систему уравнений, получаем: х = 0,25 моль; y = 0,025 моль. ν(СО2) = 0,25 моль;
- 10. Скачать презентацию
Слайд 2ν(альдегида):ν(Ag) = 1:4; ν(Ag) = 0,372·4 = 1,488 моль.
m(Ag) = ν·M =
ν(альдегида):ν(Ag) = 1:4; ν(Ag) = 0,372·4 = 1,488 моль.
m(Ag) = ν·M =
Слайд 3В результате сгорания азотсодержащего гетероцикла объем полученной газовой смеси составил 6,16 л
В результате сгорания азотсодержащего гетероцикла объем полученной газовой смеси составил 6,16 л

полученной газовой смеси по воздуху равна 1,467. Определите строение этого гетероцикла и массу сгоревшего образца, если известно,
что плотность паров гетероцикла в 1,904 раза больше плотности конечной газовой смеси.
Является ли гетероцикл ароматическим соединением? Ответ объясните.
Определим среднюю молярную массу газовой смеси и ее количество вещества:
M(г.см.) = D·Mвозд = 1,467·29г/моль = 42,543 г/моль.
ν(г.см.) =
Определим молярную массу гетероцикла:
M(гц) = M(г.см.)·1,467 = 81 г/моль.
Уравнение реакции горения гетероцикла в общем виде имеет вид:
CxHyNz + O2 = xCO2 + 0,5yN2 + 0,5yH2O.
Поскольку данные приведены для н.у. – в конечной газовой смеси присутствуют углекислый газ и азот. Пусть углекислого газа – х моль, а азота – y моль. Можно записать: x+y = 0,275. Второе уравнение составим из формулы M = m/ν. Тогда среднюю молярную массу газовой смеси можно выразить как: (44x+28y)/0,275 = 42,543. Где 44 и 28 – молярные массы углекислого газа и азота соответственно
Слайд 4Решая систему уравнений, получаем: х = 0,25 моль; y = 0,025 моль.
ν(СО2)
Решая систему уравнений, получаем: х = 0,25 моль; y = 0,025 моль.
ν(СО2)

ν(N2) = 0,025 моль; 2N → N2; ν(N) = 0,05 моль.
ν(С):ν(N) = 0,25:0,05 = 5:1. Формула гетероцикла: C5HyN.
Определим количество атомов водорода при помощи молярной массы гетероцикла:
M(C5HyN) = 12·5+y+14 = 81г/моль. Откуда y = 7. Формула гетероцикла C5H7N.
Уравнение реакции горения гетероцикла:
4С5Н7N + 27O2 = 20CO2 + 2N2 + 14H2O
ν(N2):ν(C5H7N) = 1:2. ν(C5H7N) = 0,05 моль. m(C5H7N) = ν·M = 0,05моль·81г/моль = 4,05г.
Под формулу C5H7N подходят такие структуры:




 Окислительно- восстановительные реакции в органической химии. Подготовка к ЕГЭ
Окислительно- восстановительные реакции в органической химии. Подготовка к ЕГЭ Коррозия металлов
Коррозия металлов Природные источники углеводородов. Нефть и природный газ, их применение. Полимеры
Природные источники углеводородов. Нефть и природный газ, их применение. Полимеры Презентация на тему Химические свойства многоатомных спиртов
Презентация на тему Химические свойства многоатомных спиртов  Соли как производные кислот и оснований
Соли как производные кислот и оснований Химия, химия, химия!
Химия, химия, химия! Презентация на тему Нефть. Свойства, состав, переработка
Презентация на тему Нефть. Свойства, состав, переработка  Алгоритм названия органического соединения
Алгоритм названия органического соединения Использование ИКТ в преподавании химии
Использование ИКТ в преподавании химии Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Искусство фотографии и химия
Искусство фотографии и химия Презентация на тему Алкины. Ацетилен
Презентация на тему Алкины. Ацетилен  Химические реакции
Химические реакции Химические свойства оксидов
Химические свойства оксидов Спирты и фенолы
Спирты и фенолы Степень окисления
Степень окисления Классификация химических реакций
Классификация химических реакций электролитическая диссоциация
электролитическая диссоциация Альдегиды и кетоны
Альдегиды и кетоны Аминокислоты. Пептиды. Белки. Тема 2
Аминокислоты. Пептиды. Белки. Тема 2 Фундаментальные механизмы биохимической адаптации
Фундаментальные механизмы биохимической адаптации Дивный мир турмалинов
Дивный мир турмалинов Презентация на тему День Земли, Воды и Чистого воздуха
Презентация на тему День Земли, Воды и Чистого воздуха  Презентация на тему Классификация химических реакций 11 класс
Презентация на тему Классификация химических реакций 11 класс  Анилин. Строение и свойства анилина
Анилин. Строение и свойства анилина Окислительно-восстановительные процессы
Окислительно-восстановительные процессы анлекция 3
анлекция 3 Первоначальные химические понятия. 2 раунд
Первоначальные химические понятия. 2 раунд