Содержание
- 3. Be, Mg, Ca, Sr, Ba, Ra Щелочноземельные (радиоактивен) 1. На внешнем энергетическом уровне – 2 электрона
- 4. ФИЗИЧЕСКИЕ СВОЙСТВА Легкие серебристо-белые металлы, твердые. Стронций значительно тверже бария, который по мягкости близок к свинцу.
- 5. ФИЗИЧЕСКИЕ СВОЙСТВА Бериллий Магний Кальций Стронций
- 6. ХИМИЧЕСКИЕ СВОЙСТВА 1. Взаимодействие с неметаллами: а) + O2 (горение) б ) + Cl2 в) +
- 7. 2. Со сложными веществами а) с водой (кроме Be – защищен оксидной пленкой. Mg – реагирует
- 8. СОЕДИНЕНИЯ МЕТАЛЛОВ II А ГРУППЫ Оксиды: BeO – амфотерный, другие – основные. Получение: обжиг карбонатов CaCO3
- 9. Гидроксиды - щелочи (кроме Be(OH)2 и Mg(OH)2) Получение: 1. Взаимодействие оксида с водой CaO + H2O
- 10. Соли: CaCO3 – мел, мрамор, известняк, кальцит
- 11. Мел
- 12. Мрамор
- 13. Известняк
- 14. Кальцит
- 15. CaSO4 * 2H2O - гипс
- 17. Скачать презентацию













 Фосфорні добрива. Технології збагачення фосфоровмісної сировини
Фосфорні добрива. Технології збагачення фосфоровмісної сировини ПЕРІОДИЧНИЙ ЗАКОН
ПЕРІОДИЧНИЙ ЗАКОН Химический элемент. Изотопы. Ионы
Химический элемент. Изотопы. Ионы Презентация на тему Химическая промышленность мира
Презентация на тему Химическая промышленность мира  Презентация на тему Фосфор. Соединения фосфора
Презентация на тему Фосфор. Соединения фосфора  Презентация на тему Соли
Презентация на тему Соли  Химические системы. Химическая термодинамика. Химическое равновесие
Химические системы. Химическая термодинамика. Химическое равновесие Презентация на тему Алкены. Строение. Изомерия. Химические свойства
Презентация на тему Алкены. Строение. Изомерия. Химические свойства  Полимеры и пластмассы
Полимеры и пластмассы Приминение серной кислоты в хозяйстве
Приминение серной кислоты в хозяйстве Металлы. Своя игра
Металлы. Своя игра Серная кислота и её соли. Качественная реакция на сульфат-ион
Серная кислота и её соли. Качественная реакция на сульфат-ион Кислоты
Кислоты Решение расчетных задач по химии
Решение расчетных задач по химии Кислота. Карбоновые кислоты
Кислота. Карбоновые кислоты Изучение свойств пластичных масс для лепки
Изучение свойств пластичных масс для лепки Объёмный анализ
Объёмный анализ Галогены – химические элементы
Галогены – химические элементы Коррозия металлов. Экзаменационные вопросы
Коррозия металлов. Экзаменационные вопросы Решение экспериментальных задач по теме Металлы
Решение экспериментальных задач по теме Металлы Природные и синтетические красители
Природные и синтетические красители Происхождения названий химических элементов
Происхождения названий химических элементов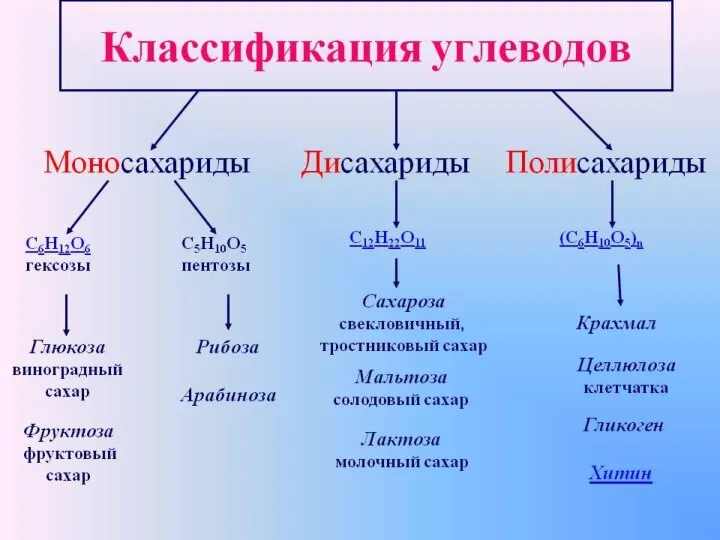 Классификация углеродов
Классификация углеродов Химическая кинетика и равновесие
Химическая кинетика и равновесие Презентация на тему Строение и свойства циклоалканов
Презентация на тему Строение и свойства циклоалканов  Строение атома. Ядро и электронная оболочка
Строение атома. Ядро и электронная оболочка Периодическая система
Периодическая система Перициклические реакции
Перициклические реакции