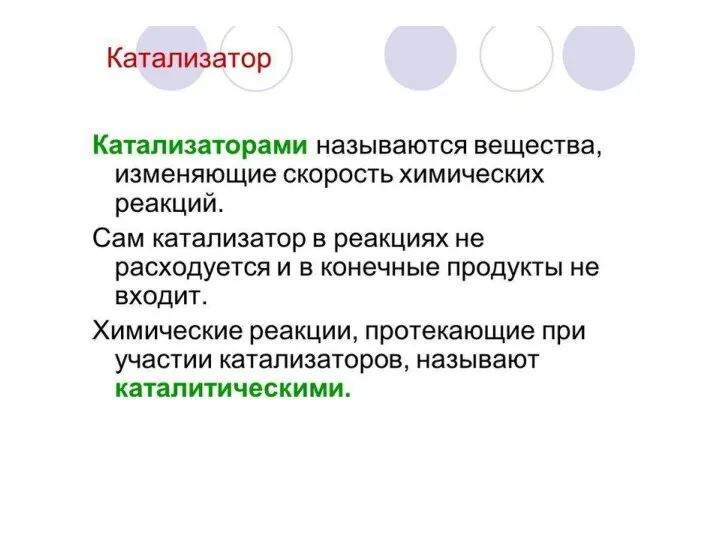
Слайд 14Катализаторы — это вещества, изменяющие скорость химической реакции или путь, по которому
она протекает, но остающиеся неизменёнными качественно и количественно
по окончании реакции.
Слайд 15Катализ — процесс изменения скорости химической реакции или пути, по которому
она
протекает.
Слайд 18Гомогенный катализ — когда катализатор
и реагирующие вещества находятся в одном
и

том же агрегатном состоянии (жидкая или газообразная фаза).
Слайд 19Гетерогенный катализ — когда реагирующие вещества находятся в одном состоянии,
а катализатор
— в другом.
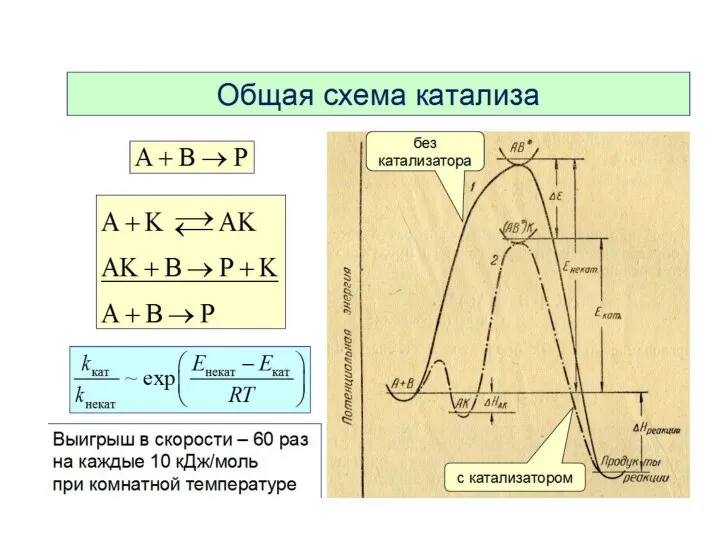
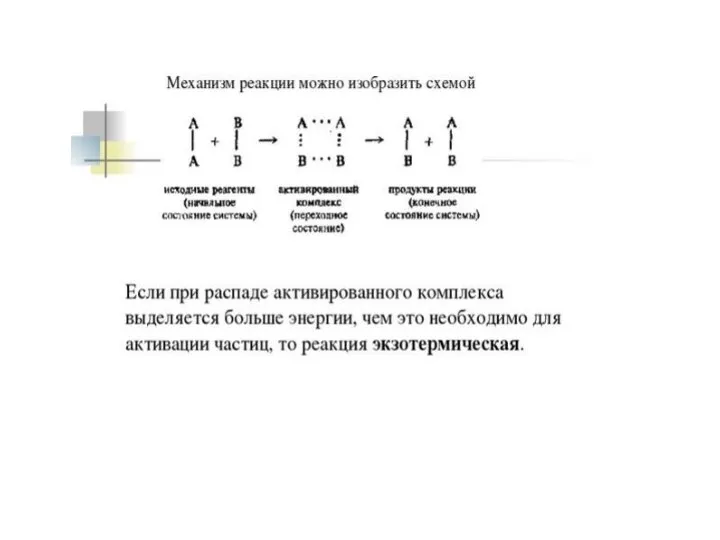
Слайд 26Для того чтобы вещества начали взаимодействовать,
их частицам нужно сообщить определённую энергию,

называемую энергией активации.
Слайд 28Энергия активации зависит от природы реагирующих веществ и пути протекания реакции и

не зависит от температуры , если с ее изменением не произошло изменений механизма реакции. Опытным путем установлено, что реакция с Еа <50 кДж/моль при 298 К идут с высокой скоростью, это характерно для реакций с участием радикалов или ионов. Если реакция имеет Еа > 100 кДж/моль, то ее скорость при 298 К неизмеримо мала
Слайд 29Источники активации реагирующих веществ:
1) термическая активация в результате подвода теплоты из окружающей

среды4
2) действие различного рода излучений (свет, проникающая радиация);
3) действие быстрых частиц, возникающих при ядерном распаде или в электрическом разряде
Слайд 30Энергия активации является очень важной энергетической
характеристикой реакции, которая связана с
константой скорости реакции

уравнением
Аррениуса:
где k – константа скорости реакции при температуре Т; А – коэффициент Аррениуса (предэкспоненциальный коэффициент), учитывающий частоту столкновения частиц
Слайд 31ориентированных определенным образом;
е – основание натурального логарифма;
Еа – энергия активации

реакции,Дж/моль;
R – универсальная газовая постоянная = 8,31 Дж/моль ٠К
Из этого уравнения следует, что чем больше энергия активации, тем меньше будут константа и скорость химической реакции, т.к. в системе будет меньше число активных частиц
Слайд 32Значение энергии активации реакции
можно определить, измерив константы
скорости этой реакции при двух разных
температурах

и используя следующее
уравнение:
k1 и k2 – константы скорости реакции при
температуре Т1 и Т2 .





























 Химические формулы. Относительная молекулярная масса. 8 класс
Химические формулы. Относительная молекулярная масса. 8 класс Химическая формула. Химия 8 класс
Химическая формула. Химия 8 класс Презентация на тему Палладий
Презентация на тему Палладий  Спирттің сақталуы туралы айтып беріңіз. Көмірқышқылының амидтік туындылары туралы айтып беріңіз
Спирттің сақталуы туралы айтып беріңіз. Көмірқышқылының амидтік туындылары туралы айтып беріңіз Конструкционные и специальные материалы холодильной техники
Конструкционные и специальные материалы холодильной техники Особенные свойства муравьиной кислоты
Особенные свойства муравьиной кислоты Химический диктант как метод формирующего оценивания
Химический диктант как метод формирующего оценивания Характеристика химического элемента по его положению в периодической системе элементов Д. И. Менделеева
Характеристика химического элемента по его положению в периодической системе элементов Д. И. Менделеева Ионные уравнения
Ионные уравнения Дисперсные системы. Лекция №7
Дисперсные системы. Лекция №7 Строение металлов и их сплавов
Строение металлов и их сплавов Алканы
Алканы Обобщение. Неметаллы
Обобщение. Неметаллы Вещество как система. Основы классификации и номенклатуры неорганических веществ
Вещество как система. Основы классификации и номенклатуры неорганических веществ Титан — металл фей
Титан — металл фей Презентация на тему Окислительно – восстановительные реакции
Презентация на тему Окислительно – восстановительные реакции  Обобщение по теме Теория химического строения органических веществ
Обобщение по теме Теория химического строения органических веществ Альдегиды и кетоны. (Лекция 6.2)
Альдегиды и кетоны. (Лекция 6.2) Алкадиены. Каучук. История открытия каучука
Алкадиены. Каучук. История открытия каучука Пищевые добавки
Пищевые добавки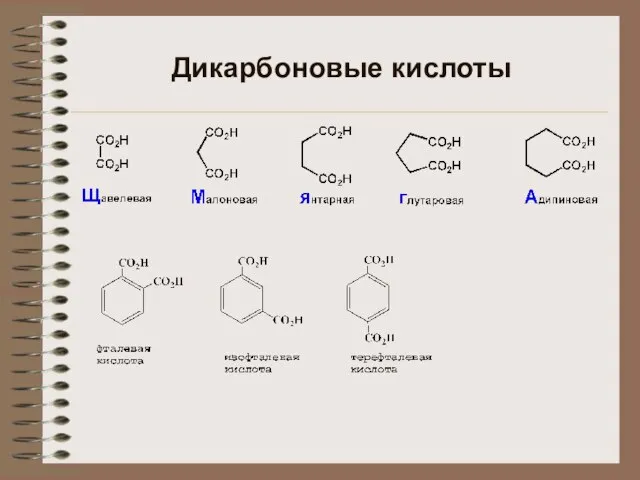 диовые кислоты
диовые кислоты Плазменное состояние вещества
Плазменное состояние вещества Катализ в нефтепереработке
Катализ в нефтепереработке Решение экспериментальных задач по теме Основные классы неорганических соединений. Практическая работа № 4
Решение экспериментальных задач по теме Основные классы неорганических соединений. Практическая работа № 4 Презентация на тему Химические свойства оксидов
Презентация на тему Химические свойства оксидов  Номенклатура алкенов. Теория
Номенклатура алкенов. Теория Вода как растворитель. Растворы. Растворимость. 8 класс
Вода как растворитель. Растворы. Растворимость. 8 класс Валентность. Составление формул по валентности
Валентность. Составление формул по валентности